

Los complejos de dinitrógeno y metales de transición son compuestos de coordinación que contienen metales de transición como centros iónicos y moléculas de dinitrógeno (N 2 ) como ligandos . [2]
Los complejos de metales de transición de N 2 se han estudiado desde 1965, cuando Allen y Senoff informaron del primer complejo. [3] Este complejo diamagnético , [Ru(NH 3 ) 5 (N 2 )] 2+ , se sintetizó a partir de hidrato de hidrazina y tricloruro de rutenio y consiste en un centro [Ru(NH 3 ) 5 ] 2+ unido a un extremo de N 2 . [4] [5] La existencia de N 2 como ligando en este compuesto se identificó mediante espectro IR con una banda fuerte alrededor de 2170–2100 cm −1 . [4] En 1966, Bottomly y Nyburg determinaron la estructura molecular de [Ru(NH 3 ) 5 (N 2 )]Cl 2 mediante cristalografía de rayos X. [6]
El complejo de dinitrógeno trans -[IrCl(N 2 )(PPh 3 ) 2 ] se obtiene tratando el complejo de Vaska con azidas de acilo aromáticas . Tiene una geometría plana. [7]
En 1967, Yamamoto y sus colaboradores informaron sobre la primera preparación de un complejo de metal-dinitrógeno utilizando dinitrógeno. Obtuvieron [Co(H)(N 2 )(PPh 3 ) 3 ] mediante la reducción de Co(acac) 3 con AlEt 2 OEt en una atmósfera de N 2 . El complejo, que contenía tanto ligandos hidrido como N 2 , tenía una relevancia potencial para la fijación de nitrógeno. [8]
Desde finales de los años 1960, se han creado diversos complejos de metales de transición y dinitrógeno, incluidos aquellos con hierro, [9] molibdeno [10] y vanadio [11] como centros metálicos. El interés en estos complejos surge porque el N 2 constituye la mayor parte de la atmósfera y porque muchos compuestos útiles contienen nitrógeno. La fijación biológica del nitrógeno probablemente ocurre a través de la unión del N 2 a esos centros metálicos en la enzima nitrogenasa , seguida de una serie de pasos que implican la transferencia de electrones y la protonación . [12]
En términos de su enlace con metales de transición, N 2 está relacionado con CO y acetileno ya que las tres especies tienen enlaces triples . Se han caracterizado una variedad de modos de enlace. Con base en si las moléculas de N 2 son compartidas por dos centros metálicos más, los complejos se pueden clasificar en mononucleares y puente. Con base en la relación geométrica entre la molécula de N 2 y el centro metálico, los complejos se pueden clasificar en modos de extremo a lado o de lado a lado. En los modos de enlace de extremo a lado de los complejos de metal de transición-dinitrógeno, el vector NN se puede considerar en línea con el centro del ion metálico, mientras que en los modos de lado a lado, se sabe que el enlace metal-ligando es perpendicular al vector NN. [13]
Como ligando, N 2 generalmente se une a los metales como un ligando "extremo", como lo ilustra [Ru(NH 3 ) 5 N 2 ] 2+ . Dichos complejos suelen ser análogos a los derivados de CO relacionados. Esta relación se ilustra mediante el par de complejos IrCl(CO)(PPh 3 ) 2 e IrCl(N 2 )(PPh 3 ) 2 . [14] En estos casos mononucleares, N 2 es tanto un donador σ como un aceptor π. Los ángulos de enlace MNN son cercanos a 180°. [2] N 2 es un aceptor pi más débil que CO, lo que refleja la naturaleza de los orbitales π* en CO vs N 2 . Por esta razón, existen pocos ejemplos de complejos que contienen tanto CO como ligando N 2 .
Los complejos de metal de transición-dinitrógeno pueden contener más de un N 2 como ligandos "de extremo", como el mer -[Mo(N 2 ) 3 (PPr n 2 Ph) 3 ], que tiene geometría octaédrica. [15] En otro ejemplo, el ligando dinitrógeno en Mo(N 2 ) 2 (Ph 2 PCH 2 CH 2 PPh 2 ) 2 se puede reducir para producir amoníaco. [16] Debido a que muchas nitrogenasas contienen Mo, ha habido un interés particular en los complejos Mo-N 2 .
El N 2 también actúa como ligando puente con enlaces "extremos" a dos centros metálicos, como lo ilustra {[Ru(NH 3 ) 5 ] 2 (μ-N 2 )} 4+ . Estos complejos también se denominan complejos de dinitrógeno multinucleares. A diferencia de su contraparte mononuclear, se pueden preparar tanto para metales de transición temprana como tardía. [2]
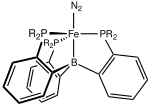
En 2006, un estudio de complejos de hierro-dinitrógeno realizado por Holland y colaboradores mostró que el enlace N–N se debilita significativamente al formar complejos con átomos de hierro con un bajo número de coordinación. El complejo involucraba ligandos quelantes bidentados unidos a los átomos de hierro en el núcleo Fe–N–N–Fe, en el que N2 actúa como un ligando puente entre dos átomos de hierro. El aumento del número de coordinación del hierro modificando los ligandos quelantes y agregando otro ligando por átomo de hierro mostró un aumento en la fuerza del enlace N–N en el complejo resultante. Por lo tanto, se sospecha que el Fe en un entorno de baja coordinación es un factor clave para la fijación de nitrógeno por la enzima nitrogenasa , ya que su cofactor Fe–Mo también presenta Fe con bajos números de coordinación. [17]
La longitud de enlace promedio de esos complejos de dinitrógeno con extremos puente es de aproximadamente 1,2 Å. En algunos casos, la longitud de enlace puede ser de hasta 1,4 Å, que es similar a la de los enlaces simples NN. [18] Hasanayn y sus colaboradores han demostrado que las estructuras de Lewis de los complejos con extremos puente se pueden asignar en función de la ocupación de orbitales moleculares π, en analogía con moléculas orgánicas tetratómicas simples. Por ejemplo, los núcleos de los complejos con puentes N2 con 8, 10 o 12 electrones π se pueden formular generalmente, respectivamente, como M≡NN≡M, M=N=N=M y MN≡NM, en analogía con las moléculas orgánicas de 8, 10 y 12 electrones π HC≡CC≡CH, O=C=C=O y FC≡CF. [19]
En comparación con su contraparte de extremo a extremo, los complejos de dinitrógeno mononucleares de lado a lado suelen tener mayor energía y los ejemplos de ellos son raros. El dinitrógeno actúa como un donador π en este tipo de complejos. Fomitchev y Coppens han informado de la primera evidencia cristalográfica de la coordinación de lado a lado de N 2 a un solo centro metálico en un estado metaestable fotoinducido. Cuando se trata con luz UV, el complejo de metal de transición-dnitrógeno, [Os(NH 3 ) 5 (N 2 )] 2+ en estados sólidos puede convertirse en un estado metaestable de [Os(NH 3 ) 5 (η 2 -N 2 )] 2+ , donde la vibración del dinitrógeno ha cambiado de 2025 a 1831 cm −1 .
Se considera que existen otros ejemplos en los estados de transición de isomerizaciones de enlaces intramoleculares. Armor y Taube han informado sobre estas isomerizaciones utilizando dinitrógeno marcado con 15 N como ligando. [20]
En un segundo modo de formación de puentes, se conocen complejos bimetálicos en los que el vector NN es perpendicular al vector MM, lo que puede considerarse como un modo lateral. Un ejemplo es [(η 5 -C 5 Me 4 H) 2 Zr] 2 ( μ 2 , η 2 ,η 2 -N 2 ). [21] El complejo dimetálico puede reaccionar con H 2 para lograr la fijación artificial de nitrógeno mediante la reducción de N 2 . [22] Un complejo de tetrahidruro de ditantalio relacionado también podría reducir N 2 . [23]
Cuando se producen complejos de nitruro metálico a partir de N2, se supone que existe un complejo de dinitrógeno como intermediario. Algunos complejos de Mo(III) también escinden N2 : [ 24]
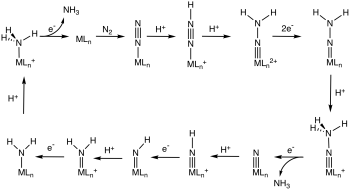
Algunos complejos de dinitrógeno metálico ricos en electrones son susceptibles al ataque de electrófilos sobre el nitrógeno. Cuando el electrófilo es un protón, la reacción es de interés en el contexto de la fijación biológica del nitrógeno . Algunos complejos de dinitrógeno metálico incluso catalizan la hidrogenación de N 2 a amoníaco en un ciclo que implica la N-protonación de un complejo MN 2 reducido . [25] [26]