La microbiota pulmonar es la comunidad microbiana pulmonar que consiste en una variedad compleja de microorganismos que se encuentran en el tracto respiratorio inferior , particularmente en la capa mucosa y las superficies epiteliales. Estos microorganismos incluyen bacterias , hongos , virus y bacteriófagos . La parte bacteriana de la microbiota ha sido estudiada más de cerca. Consiste en un núcleo de nueve géneros : Prevotella , Sphingomonas , Pseudomonas , Acinetobacter , Fusobacterium , Megasphaera , Veillonella , Staphylococcus y Streptococcus . [1] [2] [3] Son aerobios, así como anaerobios y bacterias aerotolerantes. Las comunidades microbianas son muy variables en individuos particulares y se componen de alrededor de 140 familias distintas. El árbol bronquial, por ejemplo, contiene una media de 2000 genomas bacterianos por cm 2 de superficie. Las bacterias dañinas o potencialmente dañinas también se detectan rutinariamente en muestras respiratorias. Las más importantes son Moraxella catarrhalis , Haemophilus influenzae y Streptococcus pneumoniae . Se sabe que provocan trastornos respiratorios en determinadas condiciones, como cuando el sistema inmunitario humano está afectado. Se desconoce el mecanismo por el que persisten en las vías respiratorias inferiores de individuos sanos.
Los géneros de hongos que se encuentran comúnmente conforman el micobioma pulmonar , en la microbiota del pulmón, e incluyen Candida , Malassezia , Neosartorya , Saccharomyces y Aspergillus , entre otros. [4] [5]
El epitelio de las vías respiratorias, junto con los macrófagos alveolares y las células dendríticas, desempeñan un papel importante en el reconocimiento inicial de los productos bacterianos que llegan a las vías respiratorias inferiores con el aire. Dado que algunos de estos productos son potentes estímulos proinflamatorios, es extremadamente importante que el sistema inmunitario distinga entre patógenos y comensales no patógenos. Esto evita el desarrollo de una inflamación constante y genera tolerancia contra la microbiota inofensiva. [6]
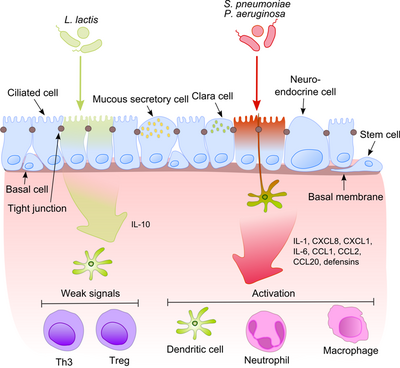
Este proceso se vuelve mucho más intrigante si tenemos en cuenta que los comensales a menudo comparten sus moléculas de superficie con los patógenos. Las células epiteliales están equipadas con herramientas de reconocimiento muy sensibles: receptores tipo Toll (TLR), receptores tipo NOD (NLR) y receptores tipo RIG-I (RLR) que reconocen una amplia variedad de componentes estructurales microbianos. Después del reconocimiento de bacterias patógenas, se activan las vías proinflamatorias y los componentes celulares de la inmunidad adaptativa e innata se reclutan en el sitio de la infección. [7] Un regulador clave en este proceso es NF-κB , que se transloca desde el citoplasma al núcleo y activa genes proinflamatorios en células epiteliales y macrófagos. El complejo de proteínas de unión al ADN reconoce una secuencia de nucleótidos discreta (5'-GGG ACT TTC T-3') en la región ascendente de una variedad de genes de respuesta. La activación de NF-κB por una serie de estímulos: paredes celulares bacterianas o citocinas inflamatorias da lugar a su translocación al núcleo.
Por el contrario, las bacterias inofensivas no provocan la translocación de NF-κB al núcleo, lo que previene la inflamación, aunque pueden expresar los mismos patrones moleculares asociados a microbios (MAMP). Neish sugirió un posible mecanismo para explicar este efecto, al demostrar que S. typhimurium no patógeno PhoPc y S. pullorum pueden inhibir la ubiquitinación del inhibidor de NF-κB, la molécula nuclear factor del polipéptido ligero de NF-κB, potenciador del gen del inhibidor de células B alfa (IκB-κ). [8] Otra explicación de la tolerancia comensal del epitelio se refiere a la modificación postraduccional de una proteína mediante la unión covalente de uno o más monómeros de ubiquitina (Ub). La inhibición de la ubiquitinación conduce a la reducción de la inflamación, porque solo el poliubiquitinado (IκB-κ) es el objetivo de la degradación por el proteasoma 26 S, lo que permite la translocación de NF-κB al núcleo y la activación de la transcripción de genes efectores (por ejemplo IL-8). Las bacterias probióticas como los lactobacilos pueden modular la actividad del sistema Ub-proteasoma mediante la inducción de la producción de especies reactivas de oxígeno (ROS) en las células epiteliales. En las células de mamíferos, se ha demostrado que las ROS sirven como segundos mensajeros críticos en múltiples vías de transducción de señales en respuesta a las citocinas proinflamatorias. Las ROS inducidas por bacterias causan la inactivación oxidativa del residuo de cisteína catalítica de Ub 12, lo que resulta en una pérdida incompleta pero transitoria de la neddilación de cullina-1 y los consiguientes efectos sobre la señalización de NF-κB y β-catenina. Otra especie comensal, B. thetaiotaomicron , atenúa la citocina proinflamatoria. expresión al promover la exportación nuclear de la subunidad RelA de NF-κB, a través de una vía dependiente del receptor activado por el proliferador de peroxisomas γ (PPAR-γ). Los PPAR-γ se dirigen a Rel A transcripcionalmente activo e inducen una depuración nuclear temprana, lo que limita la duración de la acción de NF-κB.
El equilibrio entre patógenos y comensales es extremadamente importante para el mantenimiento de la homeostasis en el tracto respiratorio.
Las vías respiratorias están continuamente expuestas a una multitud de microorganismos, algunos de los cuales son capaces de persistir e incluso colonizar el tracto respiratorio. Esto es posible gracias a la presencia de nutrientes, oxígeno y una temperatura óptima de crecimiento. Existen varias fuentes de nutrientes derivadas del huésped para los residentes microbianos: secreciones de las células epiteliales de las vías respiratorias (especialmente las células caliciformes), secreciones de las glándulas submucosas y trasudado del plasma. Además, la reserva de nutrientes disponibles aumenta gracias a las actividades de algunos miembros de la microbiota. Los componentes macromoleculares de las secreciones respiratorias (proteínas, glicoproteínas, lípidos, ácidos nucleicos) se convierten en nutrientes (por ejemplo, carbohidratos, aminoácidos). Por lo tanto, la actividad metabólica de las bacterias presentes permite la colonización de nuevas especies. Las bacterias comensales no son patógenas y defienden nuestras vías respiratorias contra los patógenos. Existen varios mecanismos posibles. Los comensales son los competidores nativos de las bacterias patógenas, porque tienden a ocupar el mismo nicho ecológico dentro del cuerpo humano. En segundo lugar, son capaces de producir sustancias antibacterianas llamadas bacteriocinas que inhiben el crecimiento de patógenos.
Los géneros Bacillus , Lactobacillus , Lactococcus , Staphylococcus , Streptococcus y Streptomyces son los principales productores de bacteriocinas en el tracto respiratorio. Además, se sabe que los comensales inducen la respuesta Th1 y la producción de interleucina (IL)-10 antiinflamatoria, péptidos antimicrobianos, FOXP3 y de inmunoglobulina A secretora (sIgA).

Los cambios en la composición de la comunidad microbiana parecen desempeñar un papel en la progresión de trastornos pulmonares como la enfermedad pulmonar obstructiva crónica (EPOC), el asma y la fibrosis quística . [9] [10] En los seres humanos, S. aureus es parte de la microbiota normal presente en el tracto respiratorio superior, [11] y en la piel y en la mucosa intestinal. [12] S. aureus , junto con especies similares que pueden colonizar y actuar simbióticamente pero pueden causar enfermedades si comienzan a apoderarse de los tejidos que han colonizado o invaden otros tejidos, se han denominado "patobiontes". [11] El SARM puede colonizar a las personas de manera similar sin enfermarlas. [13] La presencia de géneros como Mycoplasma , Pseudomonas y Staphylococcus se correlaciona con un estado estable de EPOC. Por otra parte, Prevotella , Mesorhizobium , Microbacterium , Micrococcus , Veillonela , Rhizobium , Stenotrophomonas y Lactococcus se presentan principalmente en la cohorte de individuos sanos. La abundancia relativa de Proteobacteria aumenta en niños asmáticos. Pseudomonas aeruginosa , Staphylococcus aureus y Burkholderia cepacia se encuentran con mayor frecuencia en pacientes con fibrosis quística.
La secuenciación de alto rendimiento y los enfoques de secuenciación del genoma completo proporcionarán más información sobre la complejidad y la implicación fisiológica de las bacterias comensales en el tracto respiratorio inferior.
Figura 2: Distribución de géneros fúngicos en diferentes sitios del cuerpo.
{{cite journal}}: Enlace externo en |quote=