
En la ciencia de los materiales , la microscopía de fuerza química ( CFM ) es una variación de la microscopía de fuerza atómica (AFM) que se ha convertido en una herramienta versátil para la caracterización de superficies de materiales . Con AFM, la morfología estructural se analiza mediante modos de contacto o golpeteo simples que utilizan interacciones de van der Waals entre la punta y la muestra para mantener una amplitud de deflexión de la sonda constante (modo de fuerza constante) o mantener la altura mientras se mide la deflexión de la punta (modo de altura constante). CFM, por otro lado, utiliza interacciones químicas entre la punta de la sonda funcionalizada y la muestra. La química de elección suele ser una punta y una superficie recubiertas de oro con tioles R-SH unidos, siendo R los grupos funcionales de interés. CFM permite determinar la naturaleza química de las superficies, independientemente de su morfología específica, y facilita los estudios de entalpía de enlace químico básico y energía superficial . Normalmente, el CFM está limitado por las vibraciones térmicas dentro del voladizo que sostiene la sonda. Esto limita la resolución de la medición de fuerza a ~1 pN, lo que sigue siendo muy adecuado teniendo en cuenta que las interacciones débiles COOH/CH3 son ~20 pN por par. [1] [2] La hidrofobicidad se utiliza como ejemplo principal a lo largo de esta consideración de CFM, pero ciertamente cualquier tipo de unión se puede probar con este método.
CFM fue desarrollado principalmente por Charles Lieber en la Universidad de Harvard en 1994. [1] El método se demostró utilizando hidrofobicidad donde las moléculas polares (por ejemplo, COOH) tienden a tener la unión más fuerte entre sí, seguidas de las no polares (por ejemplo, CH 3 -CH 3 ) enlace, y una combinación es el más débil. Las puntas de las sondas están funcionalizadas y los sustratos están modelados con estas moléculas. Se probaron todas las combinaciones de funcionalización, tanto mediante contacto y eliminación de la punta como mediante mapeo espacial de sustratos modelados con ambos restos y observando la complementariedad en el contraste de la imagen. Ambos métodos se analizan a continuación. El instrumento AFM utilizado es similar al de la Figura 1.
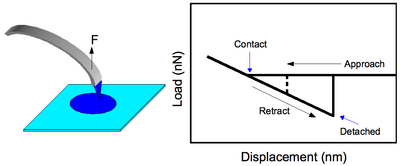
Este es el modo más simple de operación CFM donde una punta funcionalizada se pone en contacto con la superficie y se tira para observar la fuerza con la que se produce la separación (consulte la Figura 2). La teoría de la mecánica de adhesión de Johnson-Kendall-Roberts (JKR) predice este valor como [1] [2]
(1)
donde es el radio de la punta y hay varias energías superficiales entre la punta, la muestra y el medio en el que se encuentra cada uno (líquidos que se analizan a continuación). generalmente se obtiene a partir de SEM y de mediciones de ángulos de contacto en sustratos con los restos dados. Cuando se usan los mismos grupos funcionales, y lo que resulta en Hacer esto dos veces con dos restos diferentes (por ejemplo, COOH y CH 3 ) da valores de y , los cuales se pueden usar juntos en el mismo experimento para determinar . Por lo tanto, se puede calcular para cualquier combinación de funcionalidades para comparar con los valores determinados de CFM.
Para punta y superficie funcionalizadas de manera similar, en el desprendimiento de la punta, la teoría JKR también predice un radio de contacto de [2]
(2)
con un módulo de Young “efectivo” de la punta derivado del valor real y del ratio de Poisson . Si se conoce el área efectiva de un único grupo funcional (por ejemplo, a partir de simulaciones de química cuántica), se puede estimar el número total de ligandos que participan en la tensión. Como se indicó anteriormente, la resolución de fuerza de CFM permite sondear enlaces individuales de incluso Es la variedad más débil, pero la curvatura de la punta normalmente lo impide. Utilizando la ecuación 2, se determinó un radio de curvatura <10 nm como requisito para realizar pruebas de tracción de restos lineales individuales. [2]
Una nota rápida a mencionar es que el trabajo correspondiente a la histéresis en el perfil de fuerza (Figura 2) no se correlaciona con la energía de enlace. El trabajo realizado al retraer la punta se aproxima debido al comportamiento lineal de deformación siendo la fuerza y el desplazamiento inmediatamente antes de la liberación. Utilizando los resultados de Frisbie et al., [1] normalizados a los 50 grupos funcionales estimados en contacto, los valores de trabajo se estiman en 39 eV, 0,25 eV y 4,3 eV para COOH/COOH , COOH/CH 3 y CH 3. Interacciones /CH 3 , respectivamente. De manera aproximada, las energías de los enlaces intermoleculares se pueden calcular mediante: siendo el punto de ebullición. Según esto, = 32,5 meV para el ácido fórmico , HCOOH , y 9,73 meV para el metano , CH4 , siendo cada valor aproximadamente 3 órdenes de magnitud menor de lo que podría sugerir el experimento. Incluso si se considerara la pasivación de la superficie con EtOH (que se analiza más adelante), el gran error parece irrecuperable. Los enlaces de hidrógeno más fuertes tienen como máximo ~1 eV de energía. [3] Esto implica fuertemente que el voladizo tiene una constante de fuerza menor o del orden de la de las interacciones de enlace y, por lo tanto, no puede tratarse como perfectamente rígido. Esto abre una vía para aumentar la utilidad del CFM si se pueden usar voladizos más rígidos manteniendo la resolución de la fuerza.
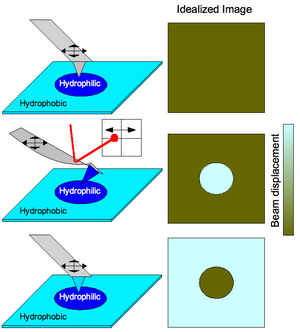
Las interacciones químicas también se pueden utilizar para mapear sustratos prediseñados con diferentes funcionalidades (ver Figura 3). El escaneo de una superficie que tiene hidrofobicidad variable con una punta que no tiene grupos funcionales adjuntos produciría una imagen sin contraste porque la superficie no tiene características morfológicas (operación simple de AFM). Funcionar una punta para que sea hidrófila provocaría que el voladizo se doblara cuando la punta escanea porciones hidrófilas del sustrato debido a fuertes interacciones entre la punta y el sustrato. Esto se detecta mediante la desviación del láser en un detector sensible a la posición , produciendo así una imagen de perfil químico de la superficie. Generalmente, un área más brillante correspondería a una mayor amplitud de deflexión, por lo que una unión más fuerte corresponde a áreas más claras de un mapa de imagen CFM. Cuando la funcionalización del voladizo se cambia de manera que la punta se dobla cuando se encuentra con áreas hidrofóbicas del sustrato, se observa la imagen complementaria.
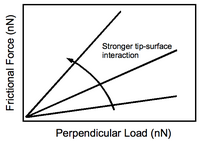
La respuesta de la fuerza de fricción a la cantidad de carga perpendicular aplicada por la punta al sustrato se muestra en la Figura 4. El aumento de las interacciones punta-sustrato produce una pendiente más pronunciada, como era de esperar. De importancia experimental es el hecho de que el contraste entre diferentes funcionalidades en la superficie puede mejorarse con la aplicación de una mayor fuerza perpendicular. Por supuesto, esto conlleva un posible daño al sustrato.
La fuerza capilar es un problema importante en las mediciones de fuerza de tracción, ya que fortalece efectivamente la interacción punta-superficie. Generalmente es causado por la humedad adsorbida en los sustratos del ambiente. Para eliminar esta fuerza adicional, se pueden realizar mediciones en líquidos. Con punta terminada en X y sustrato en líquido L, la adición a F ad se calcula usando la ecuación 1 con W XLX = 2γ LL ; es decir, la fuerza adicional proviene de la atracción de las moléculas del líquido entre sí. Esto es ~10 pN para EtOH, lo que aún permite la observación incluso de las interacciones polares/no polares más débiles (~20 pN). [2] La elección del líquido depende de qué interacciones son de interés. Cuando el disolvente es inmiscible con grupos funcionales, existe una unión entre la punta y la superficie mayor de lo habitual. Por lo tanto, los disolventes orgánicos son apropiados para estudiar Van der Waals y los enlaces de hidrógeno, mientras que los electrolitos son mejores para sondear fuerzas hidrofóbicas y electrostáticas.

Una implementación biológica de CFM a nivel nanoescalar es el despliegue de proteínas con punta y superficie funcionalizadas (ver Figura 5). [4] Debido al aumento del área de contacto, la punta y la superficie actúan como anclajes que sujetan los haces de proteínas mientras se separan. A medida que se produce el desenrollamiento, la fuerza requerida salta, lo que indica varias etapas del desenrollamiento: (1) separación en haces, (2) separación de haces en dominios de proteína cristalina mantenidas juntas por fuerzas de van der Waals y (3) linealización de la proteína al superarla. el enlace secundario. Este método proporciona información sobre la estructura interna de estas proteínas complejas, así como una mejor comprensión de las interacciones de los constituyentes.
Una segunda consideración es aquella que aprovecha las propiedades únicas de los materiales a nanoescala. La alta relación de aspecto de los nanotubos de carbono (fácilmente >1000) se aprovecha para obtener imágenes de superficies con características profundas. [5] El uso del material de carbono amplía la química de funcionalización ya que existen innumerables rutas para la modificación química de las paredes laterales de los nanotubos (por ejemplo, con diazonio, alquilos simples, hidrógeno, ozono/oxígeno y aminas). Los nanotubos de paredes múltiples se utilizan normalmente por su rigidez. Debido a sus extremos aproximadamente planos, se puede estimar el número de grupos funcionales que están en contacto con el sustrato conociendo el diámetro del tubo y el número de paredes, lo que ayuda a determinar las propiedades de tracción de los restos individuales. Ciertamente, este método también tiene implicaciones obvias en tribología .