
Una llama (del latín flamma ) es la parte gaseosa visible de un incendio . Se origina por una reacción química altamente exotérmica que se produce en una zona delgada. [1] Cuando las llamas son lo suficientemente calientes como para tener componentes gaseosos ionizados de suficiente densidad, se las considera plasma . [ vago ] [2]
El color y la temperatura de una llama dependen del tipo de combustible que interviene en la combustión. Por ejemplo, cuando se acerca un encendedor a una vela , el calor aplicado hace que las moléculas de combustible de la cera de la vela se vaporicen. [nota 1] En este estado, pueden reaccionar fácilmente con el oxígeno del aire, que emite suficiente calor en la reacción exotérmica posterior para vaporizar aún más combustible, manteniendo así una llama constante. La alta temperatura de la llama hace que las moléculas de combustible vaporizadas se descompongan , formando varios productos de combustión incompleta y radicales libres , y estos productos reaccionan entre sí y con el oxidante involucrado en la reacción de la siguiente llama (fuego).
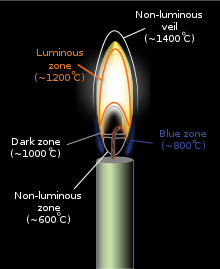
Se pueden investigar diferentes partes de la llama de una vela con la ayuda de una cuchara de metal fría: [4] las partes más altas de la llama producen deposición de vapor de agua, resultado de la combustión, las partes amarillas en el medio producen hollín y el área cerca de la mecha de la vela produce cera sin quemar. Los orfebres utilizan las partes más altas de una llama con un soplete metálico para fundir oro y plata. La energía suficiente en la llama excitará los electrones en algunos de los intermediarios de reacción transitorios, como el radical metilidina (CH) y el carbono diatómico (C 2 ), lo que da como resultado la emisión de luz visible a medida que estas sustancias liberan su exceso de energía (ver el espectro a continuación para una explicación de qué especies radicales específicas producen qué colores específicos). A medida que aumenta la temperatura de combustión de una llama (si la llama contiene pequeñas partículas de carbono sin quemar u otro material), también lo hace la energía promedio de la radiación electromagnética emitida por la llama (ver Cuerpo negro ).
Se pueden utilizar otros oxidantes además del oxígeno para producir una llama. La combustión del hidrógeno en cloro produce una llama y, en el proceso, emite cloruro de hidrógeno gaseoso (HCl) como producto de la combustión. [5] Otra de las muchas combinaciones químicas posibles es la hidracina y el tetróxido de nitrógeno , que es hipergólico y se utiliza habitualmente en los motores de cohetes. Se pueden utilizar fluoropolímeros para suministrar flúor como oxidante de combustibles metálicos, por ejemplo, en la composición de magnesio/teflón/vitón .
La cinética química que se produce en la llama es muy compleja y normalmente implica una gran cantidad de reacciones químicas y especies intermedias, la mayoría de ellas radicales . Por ejemplo, un conocido esquema de cinética química, GRI-Mech, [6] utiliza 53 especies y 325 reacciones elementales para describir la combustión del biogás .
Existen diferentes métodos para distribuir los componentes necesarios para la combustión en una llama. En una llama de difusión , el oxígeno y el combustible se difunden entre sí; la llama se produce en el punto de encuentro. En una llama premezclada , el oxígeno y el combustible se mezclan previamente, lo que da como resultado un tipo de llama diferente. Las llamas de las velas (llama de difusión) funcionan mediante la evaporación del combustible que se eleva en un flujo laminar de gas caliente que luego se mezcla con el oxígeno circundante y se quema.

El color de la llama depende de varios factores, siendo los más importantes la radiación del cuerpo negro y la emisión de banda espectral , mientras que tanto la emisión de línea espectral como la absorción de línea espectral desempeñan papeles menores. En el tipo de llama más común, las llamas de hidrocarburos , el factor más importante que determina el color es el suministro de oxígeno y el grado de premezcla de combustible y oxígeno, que determina la velocidad de combustión y, por lo tanto, la temperatura y las vías de reacción, produciendo así diferentes tonos de color.

En un laboratorio, en condiciones normales de gravedad y con una entrada de aire cerrada, un mechero Bunsen arde con una llama amarilla (también llamada llama de seguridad) con una temperatura máxima de unos 2000 K (3100 °F). El amarillo surge de la incandescencia de partículas de hollín muy finas que se producen en la llama. También se produce monóxido de carbono y la llama tiende a tomar oxígeno de las superficies que toca. Cuando se abre la entrada de aire, se produce menos hollín y monóxido de carbono. Cuando se suministra suficiente aire, no se produce hollín ni monóxido de carbono y la llama se vuelve azul. (La mayor parte de este azul había sido oscurecido previamente por las emisiones de color amarillo brillante). El espectro de una llama de butano premezclada (combustión completa) a la derecha muestra que el color azul surge específicamente debido a la emisión de radicales moleculares excitados en la llama, que emiten la mayor parte de su luz muy por debajo de ≈565 nanómetros en las regiones azul y verde del espectro visible.
La parte más fría de una llama de difusión (combustión incompleta) será roja, y pasará a naranja, amarilla y blanca a medida que aumenta la temperatura, como lo evidencian los cambios en el espectro de radiación del cuerpo negro. Para una región de llama dada, cuanto más cerca del blanco esté en esta escala, más caliente será esa sección de la llama. Las transiciones suelen ser evidentes en incendios, en los que el color emitido más cerca del combustible es blanco, con una sección naranja encima y las llamas rojizas son las más altas de todas. [7] Una llama de color azul solo emerge cuando la cantidad de hollín disminuye y las emisiones azules de los radicales moleculares excitados se vuelven dominantes, aunque el azul a menudo se puede ver cerca de la base de las velas, donde el hollín en el aire está menos concentrado. [8]
Se pueden impartir colores específicos a la llama mediante la introducción de especies excitables con líneas de espectro de emisión brillantes . En química analítica, este efecto se utiliza en pruebas de llama (o espectroscopia de emisión de llama ) para determinar la presencia de algunos iones metálicos. En pirotecnia , los colorantes pirotécnicos se utilizan para producir fuegos artificiales de colores brillantes.

Al observar la temperatura de una llama, hay muchos factores que pueden cambiar o aplicarse. Uno importante es que el color de una llama no determina necesariamente una comparación de temperatura porque la radiación del cuerpo negro no es lo único que produce o determina el color que se observa; por lo tanto, es solo una estimación de la temperatura. Otros factores que determinan su temperatura son:
Esta es una guía aproximada de las temperaturas de llama para varias sustancias comunes (en aire a 20 °C (68 °F) a 1 atm. de presión):
El dicianoacetileno , un compuesto de carbono y nitrógeno con la fórmula química C 4 N 2, arde en oxígeno con una llama azul blanquecina brillante a una temperatura de 5260 K (4990 °C; 9010 °F), y hasta 6000 K (5730 °C; 10 340 °F) en ozono . [10] Esta alta temperatura de llama se debe en parte a la ausencia de hidrógeno en el combustible (el dicianoacetileno no es un hidrocarburo), por lo que no hay agua entre los productos de combustión.
El cianógeno , con la fórmula (CN) 2 , produce la segunda llama natural más caliente conocida con una temperatura de más de 4.525 °C (8.177 °F) cuando arde en oxígeno. [11] [12]
A temperaturas tan bajas como 120 °C (248 °F), las mezclas de combustible y aire pueden reaccionar químicamente y producir llamas muy débiles llamadas llamas frías. El fenómeno fue descubierto por Humphry Davy en 1817. El proceso depende de un delicado equilibrio de temperatura y concentración de la mezcla reaccionante y, si las condiciones son las adecuadas, puede iniciarse sin ninguna fuente de ignición externa. Las variaciones cíclicas en el equilibrio de las sustancias químicas, en particular de los productos intermedios en la reacción, dan lugar a oscilaciones en la llama, con una variación típica de temperatura de unos 100 °C (212 °F), o entre la ignición "fría" y la ignición total. A veces, la variación puede provocar una explosión. [9] [13]

En el año 2000, los experimentos de la NASA confirmaron que la gravedad juega un papel indirecto en la formación y composición de la llama. [14] La distribución común de una llama en condiciones de gravedad normal depende de la convección , ya que el hollín tiende a subir a la parte superior de una llama (como en una vela en condiciones de gravedad normal), volviéndola amarilla. En un entorno de microgravedad o gravedad cero , como en órbita, la convección natural ya no ocurre y la llama se vuelve esférica, con tendencia a volverse más azul y más eficiente. Hay varias explicaciones posibles para esta diferencia, de las cuales la más probable es la hipótesis de que la temperatura está lo suficientemente distribuida uniformemente como para que no se forme hollín y se produzca una combustión completa. [15] Los experimentos de la NASA revelan que las llamas de difusión en microgravedad permiten que se oxide completamente más hollín después de que se producen que las llamas de difusión en la Tierra, debido a una serie de mecanismos que se comportan de manera diferente en microgravedad en comparación con las condiciones de gravedad normal. [16] Estos descubrimientos tienen aplicaciones potenciales en la ciencia aplicada y la industria privada, especialmente en lo que respecta a la eficiencia del combustible .
Las llamas no necesitan ser impulsadas únicamente por la liberación de energía química. En las estrellas, los frentes de combustión subsónica impulsados por la combustión de núcleos ligeros (como el carbono o el helio) a núcleos pesados (hasta el grupo del hierro) se propagan como llamas. Esto es importante en algunos modelos de supernovas de tipo Ia . En las llamas termonucleares, la conducción térmica domina sobre la difusión de especies, por lo que la velocidad y el grosor de la llama están determinados por la liberación de energía termonuclear y la conductividad térmica (a menudo en forma de electrones degenerados ). [17]