Lyman-alfa , típicamente denotada por Ly-α , es una línea espectral del hidrógeno (o, más generalmente, de cualquier átomo de un electrón ) en la serie de Lyman . Se emite cuando el electrón atómico pasa de un orbital n = 2 al estado fundamental ( n = 1), donde n es el número cuántico principal . En el hidrógeno, su longitud de onda de 1215,67 angstroms (121,567 nm o1.215 67 × 10 −7 m ), correspondiente a una frecuencia de aproximadamente2,47 × 10 15 Hz , sitúa a Lyman-alfa en la parte ultravioleta (UV) del espectro electromagnético. Más específicamente, Ly-α se encuentra en la parte ultravioleta del vacío (VUV), caracterizada por una fuerte absorción en el aire .
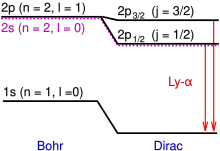
Debido a la interacción espín-órbita , la línea Lyman-alfa se divide en un doblete de estructura fina con longitudes de onda de 1215,668 y 1215,674 angstroms. [1] Estos componentes se denominan Ly-α 3/2 y Ly-α 1/2 , respectivamente.
Los estados propios del hamiltoniano perturbado están etiquetados por el momento angular total j del electrón, no solo por el momento angular orbital l . En el orbital n = 2, l = 1, hay dos estados posibles, con j = 1/2 y j = 3/2 , lo que da como resultado un doblete espectral. El j = 3/2 El estado tiene una energía más alta y, por lo tanto, está energéticamente más alejado del estado n = 1 al que está en transición. Por lo tanto, el j = 3/2El estado está asociado con la línea espectral más energética (que tiene una longitud de onda más corta) en el doblete. [2]
Como la radiación Lyman-alfa del hidrógeno es absorbida fuertemente por el aire, su observación en el laboratorio requiere el uso de sistemas espectroscópicos de vacío. Por la misma razón, la astronomía Lyman-alfa se lleva a cabo habitualmente con instrumentos a bordo de satélites, excepto para observar fuentes extremadamente distantes cuyos desplazamientos al rojo permiten que la línea penetre en la atmósfera terrestre .
La línea también se observó en antihidrógeno . [3] Dentro de las incertidumbres experimentales, la frecuencia medida es igual a la del hidrógeno, de acuerdo con las predicciones de la electrodinámica cuántica .