

En química de polímeros, la fotooxidación (a veces: fotodegradación oxidativa ) es la degradación de la superficie de un polímero debido a la acción combinada de la luz y el oxígeno. [1] Es el factor más importante en la erosión de los plásticos. [2] La fotooxidación hace que las cadenas de polímero se rompan ( escisión de cadena ), lo que hace que el material se vuelva cada vez más quebradizo. Esto conduce a fallas mecánicas y, en una etapa avanzada, a la formación de microplásticos . En textiles el proceso se llama fototendering .
Se han desarrollado tecnologías para acelerar e inhibir este proceso. Por ejemplo, se espera que los componentes plásticos de la construcción, como puertas, marcos de ventanas y canalones, duren décadas, lo que requiere el uso de estabilizadores avanzados de polímeros UV . Por el contrario, los plásticos de un solo uso pueden tratarse con aditivos biodegradables para acelerar su fragmentación. Muchos pigmentos y tintes pueden tener efectos similares debido a su capacidad para absorber la energía ultravioleta.

La susceptibilidad a la fotooxidación varía según la estructura química del polímero. Algunos materiales tienen una excelente estabilidad, como los fluoropolímeros , poliimidas , siliconas y ciertos polímeros de acrilato . Sin embargo, la producción mundial de polímeros está dominada por una variedad de plásticos básicos que representan la mayoría de los desechos plásticos . De estos, el tereftalato de polietileno (PET) tiene solo una resistencia moderada a los rayos UV y los demás, que incluyen poliestireno , cloruro de polivinilo (PVC) y poliolefinas como el polipropileno (PP) y el polietileno (PE), son todos altamente susceptibles.
La fotooxidación es una forma de fotodegradación y comienza con la formación de radicales libres en la cadena del polímero, que luego reaccionan con el oxígeno en reacciones en cadena . Para muchos polímeros, el mecanismo general de autooxidación es una aproximación razonable de la química subyacente. El proceso es autocatalítico y genera un número cada vez mayor de radicales y especies reactivas de oxígeno. Estas reacciones dan como resultado cambios en el peso molecular (y la distribución del peso molecular ) del polímero y, como consecuencia, el material se vuelve más frágil. El proceso se puede dividir en cuatro etapas:
La fotooxidación puede ocurrir simultáneamente con otros procesos como la degradación térmica , y cada uno de ellos puede acelerar al otro.
Las poliolefinas como el polietileno y el polipropileno son susceptibles a la fotooxidación y alrededor del 70% de los fotoprotectores producidos en todo el mundo se utilizan para su protección, a pesar de que representan sólo alrededor del 50% de la producción mundial de plástico. [1] Los hidrocarburos alifáticos sólo pueden adsorber rayos UV de alta energía con una longitud de onda inferior a ~250 nm; sin embargo, la atmósfera de la Tierra y la capa de ozono filtran dichos rayos, siendo la longitud de onda mínima normal de 280 a 290 nm. [3] Por lo tanto, la mayor parte del polímero es fotoinerte y la degradación se atribuye a la presencia de diversas impurezas, que se introducen durante las etapas de fabricación o procesamiento. Estos incluyen grupos hidroperóxido y carbonilo , así como sales metálicas como residuos de catalizadores.
Todas estas especies actúan como fotoiniciadores . [4] Los grupos hidroperóxido orgánico y carbonilo son capaces de absorber luz ultravioleta por encima de 290 nm, tras lo cual se someten a fotólisis para generar radicales. [5] Las impurezas metálicas actúan como fotocatalizadores , [6] aunque tales reacciones pueden ser complejas. [7] [8] También se ha sugerido que están involucrados complejos de transferencia de carga polímero-O 2 . [9] [10] La iniciación genera radicales de carbono en la cadena del polímero, a veces llamados macrorradicales (P•).

Iniciación en cadena
Propagación en cadena
Ramificación de cadena
Terminación
Clásicamente, los macrorradicales centrados en carbono (P•) reaccionan rápidamente con el oxígeno para formar radicales hidroperoxilo (POO•), que a su vez extraen un átomo de H de la cadena polimérica para dar un hidroperóxido (POOH) y un macroradical nuevo. Los hidroperóxidos se someten fácilmente a fotólisis para dar un radical macroradical alcoxilo (PO•) y un radical hidroxilo (HO•), los cuales pueden formar nuevos radicales poliméricos mediante la abstracción de hidrógeno. Se han propuesto alternativas no clásicas a estos pasos. [11] El radical alcoxilo también puede sufrir escisión beta , [12] generando una acilcetona y un macroradical. Esta se considera la principal causa de rotura de cadenas en polipropileno. [13]
Los hidroperóxidos secundarios también pueden sufrir una reacción intramolecular para dar un grupo cetona, aunque esto se limita al polietileno. [1] [14] [15] [16]
Las cetonas generadas por estos procesos son en sí mismas fotoactivas, aunque mucho más débiles. A temperatura ambiente sufren reacciones de Norrish de tipo II con escisión de cadena. [17] También pueden absorber energía ultravioleta, que luego pueden transferir al O 2 , provocando que entre en su estado singlete altamente reactivo . [18] El oxígeno singlete es un potente agente oxidante que puede provocar una mayor degradación.

Para el poliestireno, el mecanismo completo de fotooxidación sigue siendo un tema de debate, ya que diferentes vías pueden operar simultáneamente [20] y variar según la longitud de onda de la luz incidente. [21] [22] Independientemente, hay acuerdo sobre los pasos principales. [19]
El poliestireno puro no debería poder absorber luz con una longitud de onda inferior a ~280 nm y la iniciación se explica a través de impurezas fotolábiles (hidroperóxidos) y complejos de transferencia de carga, [23] todos los cuales son capaces de absorber la luz solar normal. [24] Los complejos de transferencia de carga de oxígeno y grupos fenilo de poliestireno absorben la luz para formar oxígeno singlete , que actúa como iniciador de radicales. [23] Las impurezas de carbonilo en el polímero (cf acetofenona ) también absorben luz en el rango cercano al ultravioleta (300 a 400 nm), formando cetonas excitadas capaces de extraer átomos de hidrógeno directamente del polímero. [24] El hidroperóxido sufre fotólisis para formar radicales hidroxilo y alcoxilo.
Estos pasos de iniciación generan macroradicales en los sitios terciarios, ya que estos están más estabilizados. Los pasos de propagación son esencialmente idénticos a los observados para las poliolefinas; con oxidación, abstracción de hidrógeno y fotólisis que conducen a reacciones de escisión beta y un número creciente de radicales. Estos pasos representan la mayor parte de la rotura de cadenas; sin embargo, en una vía menor, el hidroperóxido reacciona directamente con el polímero para formar un grupo cetona ( acetofenona ) y un alqueno terminal sin la formación de radicales adicionales. [25]
Se observa que el poliestireno se vuelve amarillo durante la fotooxidación, lo que se atribuye a la formación de polienos a partir de estos alquenos terminales. [25]
Los organoclorados puros como el cloruro de polivinilo (PVC) no absorben luz por encima de 220 nm. En cambio, el inicio de la fotooxidación es causado por diversas irregularidades en la cadena del polímero, como defectos estructurales [26] [27] , así como hidroperóxidos, grupos carbonilo y dobles enlaces. [28] Los hidroperóxidos formados durante el procesamiento son el iniciador más importante para empezar, [29] sin embargo, su concentración disminuye durante la fotooxidación mientras que la concentración de carbonilo aumenta, [30] ya que dichos carbonilos pueden convertirse en el iniciador principal con el tiempo. [29] [31] [32]
Los pasos de propagación involucran al radical hidroperoxilo, que puede extraer hidrógeno de los sitios de hidrocarburo (-CH 2 -) y organocloruro (-CH 2 Cl-) en el polímero a velocidades comparables. [29] [31] Los radicales formados en sitios de hidrocarburos se convierten rápidamente en alquenos con pérdida de cloro radical. Esto forma hidrógenos alílicos (que se muestran en rojo) que son más susceptibles a la abstracción de hidrógeno, lo que lleva a la formación de polienos en reacciones tipo cremallera.
Cuando los polienos contienen al menos ocho dobles enlaces conjugados, se colorean, lo que provoca un color amarillento y eventualmente un oscurecimiento del material. Esto se compensa ligeramente cuando los polienos más largos se fotoblanquean con oxígeno atmosférico; sin embargo, el PVC eventualmente se decolora a menos que haya estabilizadores de polímeros presentes. Las reacciones en los sitios organoclorados se desarrollan a través del hidroperóxido y el hidroperóxido habituales antes de que la fotólisis produzca el radical α-cloro-alcoxilo. Esta especie puede sufrir diversas reacciones para dar carbonilos, entrecruzamientos de peróxido y productos de escisión beta. [34]

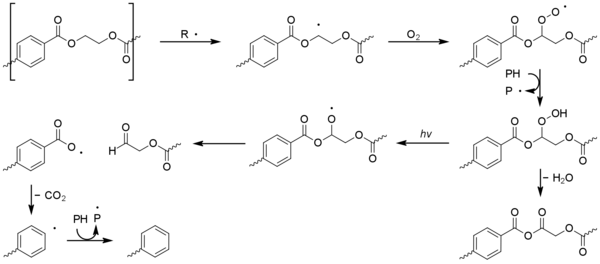
A diferencia de la mayoría de los otros plásticos básicos, el tereftalato de polietileno (PET) es capaz de absorber los rayos ultravioleta cercanos de la luz solar. La absorción comienza a 360 nm, se vuelve más intensa por debajo de 320 nm y es muy significativa por debajo de 300 nm. [1] [35] [36] A pesar de esto, el PET tiene una mejor resistencia a la fotooxidación que otros plásticos básicos , esto se debe a un rendimiento cuántico deficiente o a la absorción. [37] La química de degradación es complicada debido a las reacciones simultáneas de fotodisociación (es decir, que no involucran oxígeno) y fotooxidación de las partes aromática y alifática de la molécula. La escisión de la cadena es el proceso dominante, siendo menos común la ramificación de la cadena y la formación de impurezas coloreadas. Los principales productos son monóxido de carbono, dióxido de carbono y ácidos carboxílicos. [35] [36] La fotooxidación de otros poliésteres lineales como el tereftalato de polibutileno y el naftalato de polietileno se produce de manera similar.
La fotodisociación implica la formación de una unidad de ácido tereftálico excitada que sufre reacciones de Norrish . Domina la reacción de tipo I, que provoca la escisión de la cadena en la unidad carbonilo para dar una variedad de productos. [1] [38]

Las reacciones de Norrish de tipo II son menos comunes pero dan lugar a acetaldehído a través de ésteres de alcohol vinílico. [36] Tiene un umbral de olor y sabor extremadamente bajo y puede provocar un mal sabor en el agua embotellada. [39]
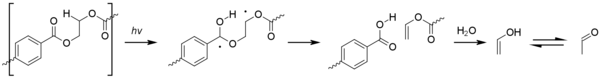
Los radicales formados por fotólisis pueden iniciar la fotooxidación en PET. La fotooxidación del núcleo de ácido tereftálico aromático da como resultado su oxidación gradual a ácido 2,5-dihidroxitereftálico. El proceso de fotooxidación en sitios alifáticos es similar al observado en las poliolefinas, y la formación de especies de hidroperóxido eventualmente conduce a la escisión beta de la cadena polimérica. [1]
Quizás sea sorprendente que el efecto de la temperatura sea a menudo mayor que el efecto de la exposición a los rayos UV. [5] Esto se puede ver en términos de la ecuación de Arrhenius , que muestra que las velocidades de reacción tienen una dependencia exponencial de la temperatura. En comparación, la dependencia de la tasa de degradación de la exposición a los rayos UV y la disponibilidad de oxígeno es ampliamente lineal. Como los océanos son más fríos que la tierra, la contaminación plástica en el medio marino se degrada más lentamente. [40] [41] Los materiales enterrados en vertederos no se degradan en absoluto por fotooxidación, aunque pueden descomponerse gradualmente mediante otros procesos.
El estrés mecánico puede afectar la tasa de fotooxidación [42] y también puede acelerar la ruptura física de los objetos plásticos. La tensión puede ser causada por carga mecánica ( esfuerzos de tracción y corte ) o incluso por ciclos de temperatura , particularmente en sistemas compuestos que consisten en materiales con diferentes coeficientes de expansión de temperatura. Del mismo modo, las lluvias repentinas pueden provocar estrés térmico .
Los tintes y pigmentos se utilizan en materiales poliméricos para proporcionar color; sin embargo, también pueden afectar la tasa de fotooxidación. Muchos absorben los rayos UV y, al hacerlo, protegen el polímero; sin embargo, la absorción puede hacer que los tintes entren en un estado excitado en el que pueden atacar al polímero o transferir energía al O 2 para formar oxígeno singlete dañino . La ftalocianina de Cu es un ejemplo; absorbe fuertemente la luz ultravioleta; sin embargo, la ftalocianina de Cu excitada puede actuar como fotoiniciador al extraer átomos de hidrógeno del polímero. [43] Sus interacciones pueden volverse aún más complicadas cuando hay otros aditivos presentes. [44] Los rellenos como el negro de humo pueden filtrar la luz ultravioleta y estabilizar eficazmente el polímero, mientras que los retardantes de llama tienden a provocar mayores niveles de fotooxidación. [45]
Se pueden agregar aditivos biodegradables a los polímeros para acelerar su degradación. En el caso de la fotooxidación se utilizan aditivos de OXO-biodegradación . [46] Se trata de sales de metales de transición como hierro (Fe) , manganeso (Mn) y cobalto (Co) . Los complejos de Fe aumentan la tasa de fotooxidación al promover la homólisis de hidroperóxidos mediante reacciones de Fenton .
El uso de tales aditivos ha sido controvertido debido a la preocupación de que los plásticos tratados no se biodegraden completamente y en cambio resulten en la formación acelerada de microplásticos . [47] Los oxoplásticos serían difíciles de distinguir del plástico no tratado, pero su inclusión durante el reciclaje de plástico puede crear un producto desestabilizado con menos usos potenciales, [48] [49] potencialmente poniendo en peligro el caso comercial para reciclar cualquier plástico. Los aditivos de biodegradación OXO fueron prohibidos en la UE en 2019 [50]
El ataque de los rayos UV por la luz solar se puede mejorar o prevenir agregando estabilizadores de polímeros anti-UV , generalmente antes de darle forma al producto mediante moldeo por inyección . Los estabilizadores UV en plásticos suelen actuar absorbiendo la radiación UV preferentemente y disipando la energía en forma de calor de bajo nivel. Los productos químicos utilizados son similares a los de los productos de protección solar , que protegen la piel del ataque de los rayos UV. Se utilizan frecuentemente en plásticos , incluidos cosméticos y películas . Se utilizan diferentes estabilizadores UV según el sustrato, la vida funcional prevista y la sensibilidad a la degradación UV. Los estabilizadores UV, como las benzofenonas , actúan absorbiendo la radiación UV y previniendo la formación de radicales libres . Dependiendo de la sustitución, el espectro de absorción UV cambia para adaptarse a la aplicación. Las concentraciones normalmente oscilan entre el 0,05% y el 2%, con algunas aplicaciones hasta el 5%.
Con frecuencia, el vidrio puede ser una mejor alternativa a los polímeros en lo que respecta a la degradación por rayos UV. La mayoría de los tipos de vidrio utilizados habitualmente son muy resistentes a la radiación UV. Las lámparas de protección contra explosiones para plataformas petrolíferas, por ejemplo, pueden fabricarse de polímero o de vidrio. En este caso, la radiación ultravioleta y las inclemencias del tiempo dañan tanto al polímero que el material debe sustituirse con frecuencia.
El poli(naftalato de etileno) (PEN) se puede proteger aplicando una capa de óxido de zinc, que actúa como una película protectora que reduce la difusión de oxígeno. [51] El óxido de zinc también se puede utilizar en policarbonato (PC) para disminuir la oxidación y la tasa de fotoamarilleo causado por la radiación solar. [52]

La fotooxidación de polímeros se puede investigar mediante pruebas climáticas naturales o aceleradas. [53] Estas pruebas son importantes para determinar la vida útil prevista de los artículos de plástico, así como el destino de los residuos de plástico .
En las pruebas climáticas naturales, las muestras de polímeros se exponen directamente al clima abierto durante un período de tiempo continuo, [54] mientras que las pruebas climáticas aceleradas utilizan una cámara de prueba especializada que simula la intemperie enviando una cantidad controlada de luz ultravioleta y agua a una muestra. Una cámara de prueba puede ser ventajosa porque se pueden controlar las condiciones climáticas exactas y las condiciones de humedad o UV pueden hacerse más intensas que en la intemperie natural. De este modo, la degradación se acelera y la prueba requiere menos tiempo.
Mediante pruebas climáticas, se puede determinar el impacto de los procesos fotooxidativos en las propiedades mecánicas y la vida útil de las muestras de polímeros. Por ejemplo, el comportamiento de tracción se puede dilucidar midiendo la curva tensión-deformación de una muestra. Esta curva tensión-deformación se crea aplicando una tensión de tracción (que se mide como la fuerza por área aplicada a una cara de muestra) y midiendo la deformación correspondiente (el cambio fraccionario de longitud). Por lo general, se aplica tensión hasta que el material se fractura y, a partir de esta curva tensión-deformación, se pueden determinar propiedades mecánicas como el módulo de Young . En general, la erosión debilita la muestra y, a medida que se vuelve más frágil, se fractura más fácilmente. Esto se observa como una disminución en la deformación elástica , la deformación por fractura y la tenacidad , así como un aumento en el módulo de Young y la tensión de rotura (la tensión a la que se fractura el material). [55]
Además de medir el impacto de la degradación en las propiedades mecánicas, la tasa de degradación de las muestras de plástico también se puede cuantificar midiendo el cambio en la masa de una muestra a lo largo del tiempo, ya que los fragmentos de microplástico pueden desprenderse del material a granel a medida que avanza la degradación y el material se vuelve más rígido. más frágil por rotura de cadena. Por lo tanto, el cambio porcentual en masa a menudo se mide en experimentos para cuantificar la degradación. [56]
También se pueden crear modelos matemáticos para predecir el cambio de masa de una muestra de polímero durante el proceso de meteorización. Debido a que la pérdida de masa ocurre en la superficie de la muestra de polímero, la tasa de degradación depende del área de la superficie. Por lo tanto, se puede elaborar un modelo para la dependencia de la degradación con respecto al área de superficie suponiendo que la tasa de cambio de masa resultante de la degradación es directamente proporcional al área de superficie SA de la muestra: [57]
Aquí, es la densidad y k d se conoce como tasa de degradación superficial específica (SSDR), que cambia según la composición química de la muestra de polímero y el entorno de intemperie. Además, para una muestra de microplástico, SA a menudo se aproxima como el área de superficie de un cilindro o esfera. Esta ecuación se puede resolver para determinar la masa de una muestra de polímero en función del tiempo.

La degradación se puede detectar antes de que se observen grietas graves en un producto mediante el uso de espectroscopía infrarroja , [58] que es capaz de detectar especies químicas formadas por fotooxidación. En particular, las especies peroxi y los grupos carbonilo tienen bandas de absorción distintas.
En el ejemplo que se muestra a la izquierda, los grupos carbonilo se detectaron fácilmente mediante espectroscopia IR a partir de una película delgada fundida. El producto era un cono de carretera fabricado mediante rotomoldeo en LDPE , que se había agrietado prematuramente durante el servicio. Muchos conos similares también fallaron porque no se utilizó un aditivo anti-UV durante el procesamiento. Otros productos de plástico que fracasaron fueron los vagones de polipropileno utilizados en obras viales, que se agrietaron después de unos pocos meses de servicio.

Los efectos de la degradación también se pueden caracterizar mediante microscopía electrónica de barrido (SEM). Por ejemplo, a través de SEM, se pueden visualizar directamente defectos como grietas y picaduras, como se muestra a la derecha. Estas muestras fueron expuestas a 840 horas de exposición a luz ultravioleta y humedad utilizando una cámara de prueba. [56] La formación de grietas a menudo se asocia con la degradación, de modo que los materiales que no muestran un comportamiento de agrietamiento significativo, como el HDPE en el ejemplo de la derecha, tienen más probabilidades de ser estables contra la fotooxidación en comparación con otros materiales como el LDPE y el PP. Sin embargo, algunos plásticos que han sufrido fotooxidación también pueden aparecer más suaves en una imagen SEM, y algunos defectos, como las ranuras, desaparecen después. Esto se ve en el poliestireno en el ejemplo de la derecha.