La conversión genética es el proceso por el cual una secuencia de ADN reemplaza una secuencia homóloga de modo que las secuencias se vuelven idénticas después de la conversión. [1] La conversión genética puede ser alélica , lo que significa que un alelo del mismo gen reemplaza a otro alelo, o ectópica , lo que significa que una secuencia de ADN paráloga convierte a otra. [2]
La conversión génica alélica ocurre durante la meiosis cuando la recombinación homóloga entre sitios heterocigóticos da como resultado un desajuste en el apareamiento de bases. Este desajuste es luego reconocido y corregido por la maquinaria celular, haciendo que uno de los alelos se convierta en el otro. Esto puede causar una segregación no mendeliana de alelos en las células germinales. [3]
La recombinación ocurre no sólo durante la meiosis, sino también como un mecanismo para reparar las roturas de doble cadena (DSB) causadas por daño del ADN. Estas DSB se reparan generalmente utilizando la cromátida hermana del dúplex roto y no el cromosoma homólogo, por lo que no darían lugar a una conversión alélica. La recombinación también ocurre entre secuencias homólogas presentes en diferentes loci genómicos (secuencias parálogas) que han resultado de duplicaciones genéticas anteriores. Se conjetura que la conversión genética que ocurre entre secuencias parálogas ( conversión genética ectópica ) es responsable de la evolución concertada de las familias de genes. [3] [4] [5]
La conversión de un alelo en otro suele deberse a la reparación de un desajuste de bases durante la recombinación homóloga : si una de las cuatro cromátidas durante la meiosis se empareja con otra cromátida, como puede ocurrir debido a la homología de secuencia , puede producirse una transferencia de la cadena de ADN seguida de una reparación del desajuste. Esto puede alterar la secuencia de uno de los cromosomas, de modo que sea idéntico al otro.
La recombinación meiótica se inicia mediante la formación de una rotura de doble cadena (DSB). Los extremos 5' de la rotura se degradan, dejando largos salientes 3' de varios cientos de nucleótidos. Uno de estos segmentos de ADN monocatenario 3' invade entonces una secuencia homóloga en el cromosoma homólogo, formando un intermedio que puede repararse a través de diferentes vías que dan lugar a entrecruzamientos (CO) o no entrecruzamientos (NCO). En varios pasos del proceso de recombinación, se forma ADN heterodúplex (ADN bicatenario que consta de hebras simples de cada uno de los dos cromosomas homólogos que pueden o no ser perfectamente complementarios). Cuando se producen desajustes en el ADN heterodúplex, la secuencia de una hebra se reparará para unirse a la otra hebra con complementariedad perfecta, lo que conduce a la conversión de una secuencia en otra. Este proceso de reparación puede seguir cualquiera de dos vías alternativas como se ilustra en la Figura. Por una vía, se forma una estructura llamada doble unión de Holliday (DHJ), que conduce al intercambio de cadenas de ADN. Por la otra vía, conocida como anexión de cadenas dependiente de síntesis (SDSA), hay intercambio de información, pero no intercambio físico. La conversión génica se producirá durante la SDSA si las dos moléculas de ADN son heterocigotas en el sitio de la reparación recombinatoria. La conversión génica también puede producirse durante la reparación recombinatoria que involucra una DHJ, y esta conversión génica puede estar asociada con la recombinación física de los dúplex de ADN en los dos lados de la DHJ.
La conversión génica sesgada (BGC) ocurre cuando un alelo tiene una mayor probabilidad de ser el donante que el otro en un evento de conversión génica. Por ejemplo, cuando se produce un desajuste T:G, sería más o menos probable que se corrija a un par C:G que a un par T:A. Esto le da a ese alelo una mayor probabilidad de transmisión a la siguiente generación. La conversión génica no sesgada significa que ambas posibilidades ocurren con la misma probabilidad.
La conversión génica sesgada por GC (gBGC) es el proceso por el cual el contenido de GC del ADN aumenta debido a la conversión génica durante la recombinación. [4] Existe evidencia de gBGC para levaduras y humanos y la teoría se ha probado más recientemente en otros linajes eucariotas. [6] En secuencias de ADN humano analizadas, se ha encontrado que la tasa de cruce se correlaciona positivamente con el contenido de GC. [4] Las regiones pseudoautosómicas (PAR) de los cromosomas X e Y en humanos, que se sabe que tienen altas tasas de recombinación, también tienen altos contenidos de GC. [3] Ciertos genes de mamíferos que experimentan una evolución concertada (por ejemplo, operones ribosómicos, ARNt y genes de histonas) son muy ricos en GC. [3] Se ha demostrado que el contenido de GC es mayor en genes de histonas humanos y de ratón parálogos que son miembros de grandes subfamilias (presumiblemente en evolución concertada) que en genes de histonas parálogos con secuencias relativamente únicas. [7] También hay evidencia de sesgo de GC en el proceso de reparación de desajustes. [3] Se cree que esto puede ser una adaptación a la alta tasa de desaminación de metilcitosina que puede conducir a transiciones C→T.
El gen Fxy o Mid1 en algunos mamíferos estrechamente relacionados con los ratones domésticos (humanos, ratas y otras especies de Mus) se encuentra en la región ligada al sexo del cromosoma X. Sin embargo, en Mus musculus , se ha translocado recientemente de manera que el extremo 3' del gen se superpone con la región PAR del cromosoma X, que se sabe que es un punto caliente de recombinación. Esta porción del gen ha experimentado un aumento dramático en el contenido de GC y la tasa de sustitución en la posición del tercer codón, así como en los intrones, pero la región 5' del gen, que está ligada al cromosoma X, no lo ha hecho. Debido a que este efecto está presente solo en la región del gen que experimenta un aumento en la tasa de recombinación, debe deberse a una conversión génica sesgada y no a una presión selectiva. [4]
El contenido de GC varía ampliamente en el genoma humano (40-80%), pero parece haber grandes secciones del genoma donde el contenido de GC es, en promedio, mayor o menor que en otras regiones. [3] Estas regiones, aunque no siempre muestran límites claros, se conocen como isocoros. Una posible explicación para la presencia de isocoros ricos en GC es que evolucionaron debido a la conversión génica sesgada por GC en regiones con altos niveles de recombinación.
Los estudios de conversión génica han contribuido a nuestra comprensión de la función adaptativa de la recombinación meiótica. El patrón de segregación habitual de un par de alelos (Aa) entre los 4 productos de la meiosis es 2A:2a. La detección de eventos de conversión génica poco frecuentes (por ejemplo, patrones de segregación 3:1 o 1:3 durante meiosis individuales) proporciona información sobre las vías alternativas de recombinación que conducen a cromosomas cruzados o no cruzados. Se cree que los eventos de conversión génica surgen cuando los alelos "A" y "a" están cerca de la ubicación exacta de un evento de recombinación molecular. Por lo tanto, es posible medir la frecuencia con la que los eventos de conversión génica se asocian con el cruce o no cruce de regiones cromosómicas adyacentes al evento de conversión inmediato, pero fuera del mismo. Se han llevado a cabo numerosos estudios de conversión génica en varios hongos (que son especialmente adecuados para tales estudios), y Whitehouse ha revisado los hallazgos de estos estudios. [8] De esta revisión se desprende claramente que la mayoría de los eventos de conversión génica no están asociados con el intercambio de marcadores externos. Por lo tanto, la mayoría de los eventos de conversión génica en los diferentes hongos estudiados están asociados con la no superposición de marcadores externos. Los eventos de conversión génica sin superposición se producen principalmente mediante la anexión de cadenas dependiente de la síntesis (SDSA). [9] Este proceso implica un intercambio limitado de información, pero no un intercambio físico de ADN, entre los dos cromosomas homólogos participantes en el sitio del evento de conversión, y se produce poca variación genética. Por lo tanto, las explicaciones de la función adaptativa de la recombinación meiótica que se centran exclusivamente en el beneficio adaptativo de producir nueva variación genética o intercambio físico parecen inadecuadas para explicar la mayoría de los eventos de recombinación durante la meiosis. Sin embargo, la mayoría de los eventos de recombinación meiótica pueden explicarse mediante la propuesta de que son una adaptación para la reparación de daños en el ADN que se transmitirá a los gametos. [10]
De particular interés, desde el punto de vista de que la recombinación es una adaptación para la reparación del ADN, son los estudios en levadura que muestran que la conversión genética en células mitóticas aumenta con la radiación UV [11] [12] y la radiación ionizante [13].
En las discusiones sobre enfermedades genéticas en humanos, las conversiones génicas mediadas por pseudogenes que introducen mutaciones patógenas en genes funcionales es un mecanismo de mutación bien conocido. En contraste, es posible que los pseudogenes puedan servir como plantillas. Durante el curso de la evolución, los genes fuente funcionales que son potencialmente ventajosos se han derivado de múltiples copias en su único gen fuente. Los cambios de plantilla de pseudogenes podrían eventualmente volverse fijos siempre que no posean efectos perjudiciales. [14] Por lo tanto, de hecho, los pseudogenes pueden actuar como fuentes de variantes de secuencia que pueden transferirse a genes funcionales en nuevas combinaciones y pueden ser objeto de acción por selección . La lectina 11 ( SIGLEC 11), una inmunoglobulina humana que se une al ácido siálico, puede considerarse un ejemplo de un evento de conversión génica de este tipo que ha jugado un papel significativo en la evolución. Al comparar los genes homólogos del SIGLEC11 humano y su pseudogén en el chimpancé , el gorila y el orangután , parece que hubo una conversión génica de la secuencia de las regiones 5' aguas arriba y los exones que codifican el dominio de reconocimiento del ácido siálico, aproximadamente a 2 kbp del pseudogén hSIGLECP16 que lo flanquea de cerca (Hayakawa et al., 2005). Las tres piezas de evidencia relacionadas con este evento han sugerido en conjunto que esto es un cambio adaptativo que es muy importante evolutivamente en el género Homo . Estas incluyen que solo en el linaje humano ocurrió esta conversión génica, la corteza cerebral ha adquirido una expresión importante de SIGLEC11 específicamente en el linaje humano y la exhibición de un cambio en la unión del sustrato en el linaje humano en comparación con el de su contraparte en los chimpancés. Por supuesto, la frecuencia de la contribución de este mecanismo de conversión génica mediado por pseudogén a los cambios funcionales y adaptativos en la evolución de los humanos aún se desconoce y hasta ahora ha sido escasamente explorada. [15] A pesar de ello, la introducción de cambios genéticos selectivamente positivos mediante dicho mecanismo puede ser propuesta para su consideración a partir del ejemplo de SIGLEC11. A veces, debido a la interferencia de elementos transponibles en algunos miembros de una familia de genes, se produce una variación entre ellos y, finalmente, también puede detenerse la tasa de conversión génica debido a la falta de similitud de secuencias, lo que conduce a una evolución divergente .
A partir de varios análisis del genoma, se concluyó que las roturas de doble cadena (DSB) se pueden reparar mediante recombinación homóloga mediante al menos dos vías diferentes pero relacionadas. [14] En el caso de la vía principal, se emplearán secuencias homólogas en ambos lados de la DSB, lo que parece ser análogo al modelo de reparación de DSB conservador [16] que se propuso originalmente para la recombinación meiótica en levadura. [17] mientras que la vía secundaria está restringida a un solo lado de la DSB como postula el modelo de invasión unilateral no conservador. [18] Sin embargo, en ambos casos la secuencia de los socios de recombinación se conservará absolutamente. En virtud de su alto grado de homología, las nuevas copias de genes que surgieron después de la duplicación genética tienden naturalmente a eventos de cruce desigual o conversión génica unidireccional. En el último proceso, existen las secuencias aceptora y donante y la secuencia aceptora será reemplazada por una secuencia copiada del donante, mientras que la secuencia del donante permanece sin cambios. [15]
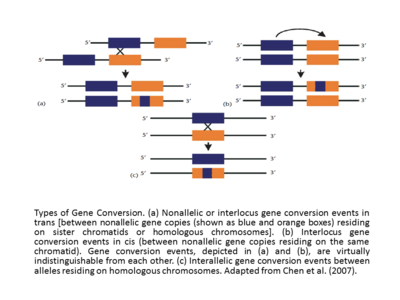
La homología efectiva entre las secuencias interactuantes hace que el evento de conversión génica sea exitoso. Además, la frecuencia de conversión génica es inversamente proporcional a la distancia entre las secuencias interactuantes en cis, [19] [14] y la tasa de conversión génica suele ser directamente proporcional a la longitud del tracto de secuencia ininterrumpida en la región convertida asumida. Parece que los tractos de conversión que acompañan al cruce son más largos (longitud media = ~460 pb) que los tractos de conversión sin cruce (longitud media = 55–290 pb). [20] En los estudios de genes de globulina humana, se ha apoyado durante mucho tiempo que el evento de conversión génica o los eventos de migración de ramificación pueden ser promovidos o inhibidos por los motivos específicos que existen en la proximidad de la secuencia de ADN (Papadakis y Patrinos, 1999). [14] Otra clasificación básica de los eventos de conversión génica es la conversión génica interlocus (también llamada no alélica) e interalélica. Los eventos de conversión génica no alélica cis o trans o interlocus ocurren entre copias de genes no alélicos que residen en cromátidas hermanas o cromosomas homólogos y, en caso de interalélico, los eventos de conversión génica tienen lugar entre alelos que residen en cromosomas homólogos (Adaptado de Chen et al., (2007). [15] [14] Si se comparan los eventos de conversión génica interlocus, se revelará con frecuencia que exhiben direccionalidad sesgada. A veces, como en el caso de los genes de globina humana (Papadakis y Patrinos, 1999), [14] la dirección de conversión génica se correlaciona con los niveles de expresión relativa de los genes que participan en el evento, con el gen expresado en un nivel más alto, llamado el gen "maestro", convirtiendo a aquel con menor expresión, llamado el gen "esclavo". Originalmente formulada en un contexto evolutivo, la regla del "gen maestro/esclavo" debe explicarse con cautela. De hecho, el aumento en la transcripción génica exhibe no solo el aumento en la probabilidad de que se use como un donante pero también un aceptor. [14] [21]
Normalmente, un organismo que ha heredado diferentes copias de un gen de cada uno de sus progenitores se denomina heterocigoto. Esto se representa genéricamente como genotipo: Aa (es decir, una copia de la variante ( alelo ) 'A' y una copia del alelo 'a'). Cuando un heterocigoto crea gametos por meiosis , los alelos normalmente se duplican y terminan en una proporción de 2:2 en las 4 células resultantes que son los productos directos de la meiosis. Sin embargo, en la conversión génica, se observa una proporción distinta a la esperada 2A:2a, en la que A y a son los dos alelos. Algunos ejemplos son 3A:1a y 1A:3a. En otras palabras, puede haber, por ejemplo, tres veces más alelos A que alelos a expresados en las células hijas, como es el caso en 3A:1a.
La conversión genética que da lugar a la mutación del gen CYP21A2 es una causa genética subyacente común de la hiperplasia suprarrenal congénita . La conversión genética somática es uno de los mecanismos que pueden dar lugar al retinoblastoma familiar , un cáncer congénito de la retina , y se cree que la conversión genética puede desempeñar un papel en el desarrollo de la enfermedad de Huntington .