La ley de Gay-Lussac suele referirse a la ley de combinación de volúmenes de gases de Joseph-Louis Gay-Lussac , descubierta en 1808 y publicada en 1809. [1] Sin embargo, a veces se refiere a la proporcionalidad del volumen de un gas a su temperatura absoluta a presión constante . Esta última ley fue publicada por Gay-Lussac en 1802, [2] pero en el artículo en el que describió su trabajo, citó un trabajo anterior inédito de la década de 1780 de Jacques Charles . En consecuencia, la proporcionalidad volumen-temperatura suele conocerse como Ley de Charles .
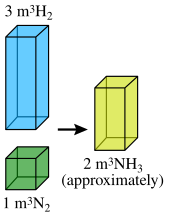
La ley de combinación de volúmenes establece que cuando los gases reaccionan químicamente entre sí, lo hacen en cantidades en volumen que guardan pequeñas proporciones entre números enteros (los volúmenes calculados a la misma temperatura y presión).
La relación entre los volúmenes de los gases reactivos y los productos gaseosos se puede expresar en números enteros simples .
Por ejemplo, Gay-Lussac descubrió que dos volúmenes de hidrógeno reaccionan con un volumen de oxígeno para formar dos volúmenes de agua gaseosa. Expresado de manera concreta, 100 mL de hidrógeno se combinan con 50 mL de oxígeno para dar 100 mL de vapor de agua: Hidrógeno(100 mL) + Oxígeno(50 mL) = Agua(100 mL). Por lo tanto, los volúmenes de hidrógeno y oxígeno que se combinan (es decir, 100 mL y 50 mL) tienen una relación simple de 2:1, como también es el caso de la relación entre el vapor de agua del producto y el oxígeno del reactivo.
Basándose en los resultados de Gay-Lussac, Amedeo Avogadro planteó en 1811 la hipótesis de que, a la misma temperatura y presión, volúmenes iguales de gases (de cualquier tipo) contienen el mismo número de moléculas ( ley de Avogadro ). Señaló que si esta hipótesis es cierta, entonces el resultado antes expuesto
También podría expresarse como
La ley de combinación de volúmenes de gases fue anunciada públicamente por Joseph Louis Gay-Lussac el último día de 1808 y publicada en 1809. [3] [4] Dado que no había evidencia directa de la teoría molecular de Avogadro, muy pocos químicos adoptaron la hipótesis de Avogadro como generalmente válida hasta que el químico italiano Stanislao Cannizzaro argumentó convincentemente a favor de ella durante el Primer Congreso Químico Internacional en 1860. [5]
En el siglo XVII, Guillaume Amontons descubrió una relación regular entre la presión y la temperatura de un gas a volumen constante. Algunos libros de texto introductorios de física todavía definen la relación presión-temperatura como la ley de Gay-Lussac. [6] [7] [8] Gay-Lussac investigó principalmente la relación entre el volumen y la temperatura y la publicó en 1802, pero su trabajo incluyó algunas comparaciones entre presión y temperatura. [9] Dada la tecnología relativa disponible para ambos hombres, Amontons solo podía trabajar con aire como gas, mientras que Gay-Lussac pudo experimentar con múltiples tipos de gases comunes, como el oxígeno, el nitrógeno y el hidrógeno. [10]
Respecto a la relación volumen-temperatura, Gay-Lussac atribuyó sus hallazgos a Jacques Charles porque utilizó muchos de los datos inéditos de Charles de 1787; por lo tanto, la ley se conoció como la ley de Charles o la ley de Charles y Gay-Lussac. [11]
Las leyes de Amontons, Charles y Boyle forman la ley combinada de los gases . Estas tres leyes de los gases, en combinación con la ley de Avogadro, pueden generalizarse mediante la ley de los gases ideales .
Gay-Lussac utilizó la fórmula obtenida de ΔV/V = αΔT para definir la tasa de expansión α de los gases. Para el aire, halló una expansión relativa ΔV/V = 37,50% y obtuvo un valor de α = 37,50%/100 °C = 1/266,66 °C, lo que indicaba que el valor del cero absoluto era aproximadamente 266,66 °C por debajo de 0 °C. [12] El valor de la tasa de expansión α es aproximadamente el mismo para todos los gases y a esto también se lo denomina a veces Ley de Gay-Lussac. Véase la introducción de este artículo y la Ley de Charles .