El ensayo de transcripción de casete sin G es un método utilizado en biología molecular para determinar la fuerza del promotor in vitro . La técnica implica la cuantificación de un producto de ARNm con el uso de un plásmido. [1] El casete sin G es parte de un vector preconstruido, que generalmente contiene un sitio de clonación múltiple (MCS) aguas arriba del casete. Por esta razón, los promotores de interés se pueden insertar directamente en el MCS para medir en última instancia la precisión y la eficiencia de un promotor en el reclutamiento de la maquinaria de transcripción.
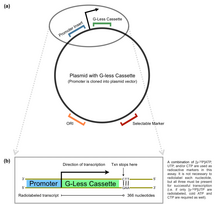
El casete G-less es un gen reportero que codifica una transcripción que carece de nucleótidos de guanina en la cadena sentido del ADN (de ahí " G -less"). [2] Un plásmido que contiene un gen de este tipo se encuentra aguas abajo de un MCS. Después de que el promotor se inserta en el MCS, la transcripción procede con la adición de UTP, CTP y ATP radiomarcados (así como nucleótidos no radiomarcados/fríos) y continúa hasta que se alcanza el final del casete G-less y los residuos de guanina vuelven a ser evidentes en la cadena sentido del ADN. La ausencia de GTP in vitro da como resultado que la transcripción se termine prematuramente en el primer residuo de guanina en la cadena sentido después del casete. Se realiza una electroforesis en gel sobre los productos de transcripción y se cuantifica la cantidad de radiactividad mediante autorradiografía o fosfoimagen para determinar la fuerza del promotor de interés.
La técnica de casete sin G se utiliza para determinar la fuerza del promotor más allá de los niveles basales de transcripción (es decir, en presencia de activadores de transcripción o factores de transcripción [3] ). Por ejemplo, para medir los efectos de una modificación de la secuencia de consenso de la caja TATA en Saccharomyces cerevisiae en presencia de TFIID , se implementaron casetes sin G para medir la fuerza relativa de cada promotor. [4]
El ensayo G-less se puede realizar en un plásmido circular para medir los niveles de transcripción. Un plásmido circular proporciona una plantilla más eficiente en muchos sistemas en comparación con otros ensayos como la transcripción de runoff, en la que se requiere un extremo escindido. Este método genera transcripciones radiomarcadas de manera muy eficiente porque evita el proceso innecesario de realizar otras mediciones indirectas del producto de ARNm. El promotor se inserta en un plásmido circular que contiene el casete G-less, que generará una transcripción de una cierta longitud que omite la transcripción aleatoria y no específica en todo el plásmido. La mayoría de los sistemas crudos, como los extractos nucleares de HeLa, se utilizan porque contienen bajas cantidades de GTP contaminante que conducen a la transcripción de fondo y, ocasionalmente, pueden hacer que la transcripción aleatoria se lea a través del casete G-less. [5]