Los compuestos químicos que se presentan como pares de imágenes especulares son denominados por los químicos moléculas quirales o de doble mano. [1] Cada gemelo se denomina enantiómero . Los fármacos que presentan doble mano se denominan fármacos quirales . Los fármacos quirales que son mezclas equimolar (1:1) de enantiómeros se denominan fármacos racémicos y, obviamente, carecen de rotación óptica. La unidad estereogénica más común [2] , que confiere quiralidad a las moléculas de los fármacos, es el centro estereogénico. El centro estereogénico puede deberse a la presencia de átomos tetracoordinados tetraédricos (C, N, P) y átomos tricordinados piramidales (N, S). La palabra quiral describe la arquitectura tridimensional de la molécula y no revela la composición estereoquímica. Por lo tanto, "fármaco quiral" no dice si el fármaco es racémico (fármaco racémico), de un solo enantiómero (fármaco quiral específico) o alguna otra combinación de estereoisómeros. Para resolver este problema, Joseph Gal introdujo un nuevo término llamado unichiral. [3] [4] Unichiral indica que la composición estereoquímica de un fármaco quiral es homogénea y consiste en un solo enantiómero.
Muchos agentes medicinales importantes para la vida son combinaciones de gemelos idénticos. A pesar de la gran similitud de estos gemelos, las diferencias en sus propiedades biológicas pueden ser profundas. En otras palabras, los enantiómeros componentes de un fármaco quiral racémico pueden diferir enormemente en su perfil farmacocinético y farmacodinámico. [5] [6] [7] [8] La tragedia de la talidomida ilustra el potencial de consecuencias extremas resultantes de la administración de un fármaco racemato que exhibe múltiples efectos atribuibles a enantiómeros individuales. [9] Con los avances en la tecnología quiral y la mayor conciencia sobre las consecuencias tridimensionales de la acción y disposición de los fármacos surgió el campo especializado de la "farmacología quiral". Simultáneamente, también evolucionó el sistema de nomenclatura de la quiralidad. A continuación se ofrece una breve descripción general de la historia de la quiralidad y la terminología/descriptores. Una cronología detallada de la quiralidad no es el foco de este artículo.

La quiralidad se remonta a 1812, cuando el físico Jean-Baptiste Biot descubrió un fenómeno llamado "actividad óptica". [10] Louis Pasteur , un famoso alumno de Biot, realizó una serie de observaciones que lo llevaron a sugerir que la actividad óptica de algunas sustancias es causada por su asimetría molecular, que produce imágenes especulares no superponibles. En 1848, Pasteur hizo crecer dos tipos diferentes de cristales a partir de la sal racémica de sodio y amonio del ácido tartárico. Fue la primera persona en separar cristales enantioméricos a mano. [11] De hecho, Pasteur sentó las bases de la estereoquímica y la quiralidad.
En 1874, Jacobus Henricus van 't Hoff propuso la idea del átomo de carbono asimétrico. Afirmó que todos los compuestos de carbono ópticamente activos tienen un átomo de carbono asimétrico. [12] Ese mismo año, Joseph Achille Le Bel solo utilizó argumentos de asimetría y habló de la asimetría de las moléculas en su conjunto en lugar de la asimetría de cada átomo de carbono. [13] Por tanto, la idea de Le Bel podría considerarse como la teoría general de la estereoisomería, mientras que la de van 't Hoff podría considerarse como un caso especial (restringido al carbono tetraédrico).
Pronto, los científicos comenzaron a investigar qué significaban los compuestos quirales para los seres vivos. En 1903, Cushny fue la primera persona en demostrar que los enantiómeros de una molécula quiral tienen diferentes efectos biológicos. [14] Lord Kelvin utilizó la palabra "quiral" por primera vez en 1904. [15]
En este artículo se ofrece una descripción general del sistema de nomenclatura de quiralidad en evolución que se emplea comúnmente para distinguir los enantiómeros de un fármaco quiral. Al principio, los enantiómeros se distinguían en función de su capacidad para rotar el plano de la luz polarizada. El enantiómero que rota la luz polarizada hacia la derecha se denomina "dextrorrotatorio", abreviado como "dextro" o "d" y su contraparte como "levo" o "l" . Una mezcla racémica se denota como "(±)", "rac" o "dl" . Ahora, el sistema de nomenclatura d/l basado en la rotación óptica está cayendo en desuso.
Más tarde, se introdujo la convención de Fischer [16] [17] para especificar la configuración de un centro estereogénico y utiliza los símbolos D y L. El uso de letras mayúsculas es para diferenciarse de la notación "d" / "l" (descriptor óptico) descrita anteriormente. En este sistema, los enantiómeros se nombran con referencia a D- y L-gliceraldehído, que se toma como estándar para la comparación. La estructura de la molécula quiral debe representarse en la fórmula de proyección de Fischer. Si el grupo hidroxilo unido al carbono quiral más alto está en el lado derecho, se denomina serie D y si está en el lado izquierdo, se denomina serie L. Este sistema de nomenclatura también se ha vuelto obsoleto. Pero el sistema de nomenclatura D-/L todavía se emplea para designar la configuración de aminoácidos y azúcares. En general, el sistema de nomenclatura D/L ha sido reemplazado por la regla de Cahn-Ingold-Prelog (CIP) para describir la configuración de un centro estereogénico/quiral.
En la convención CIP o R/S, o regla de secuencia, la configuración, las disposiciones espaciales de los ligandos/sustituyentes alrededor de un centro quiral, se etiqueta como "R" o "S". [18] [2] Esta convención ahora se usa casi en todo el mundo y se ha convertido en parte de las reglas de nomenclatura de la IUPAC (Unión Internacional de Química Pura y Aplicada). En este enfoque: identificar el centro quiral, etiquetar los cuatro átomos directamente unidos al centro estereogénico en cuestión, asignar prioridades de acuerdo con la regla de secuencia (de 1 a 4), rotar la molécula hasta que el sustituyente de menor prioridad (número 4) esté alejado del observador/observador, dibujar una curva desde el sustituyente número 1 al número 2 al número 3. Si la curva va en el sentido de las agujas del reloj, el centro quiral tiene una configuración absoluta R, "R" (del latín, rectus = derecha). Si la curva va en el sentido contrario a las agujas del reloj, el centro quiral tiene una configuración absoluta S, "S" (del latín, sinister = izquierda). Consulte la figura, la regla de Cahn-Ingold-Prelog.
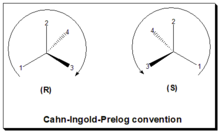
En la siguiente tabla se presenta una descripción general del sistema de nomenclatura.
Durante muchos años, los científicos que se dedican al desarrollo de fármacos han sido ciegos a las consecuencias tridimensionales de la estereoquímica, debido principalmente a la falta de tecnología para realizar investigaciones enantioselectivas. Además de la tragedia de la talidomida, otro acontecimiento que puso de relieve la importancia de las cuestiones de la estereoquímica en la investigación y el desarrollo de fármacos fue la publicación en 1984 de un manuscrito titulado "Estereoquímica, una base de sofisticados disparates en farmacocinética y farmacología clínica" de Ariëns. [19] Este artículo, y la serie de artículos que le siguieron, criticaron la práctica de realizar estudios farmacocinéticos y farmacodinámicos sobre fármacos racémicos e ignorar las contribuciones separadas de los enantiómeros individuales. [20] [21] [22] [23] [24] [25] Estos artículos han servido para cristalizar algunas de las cuestiones importantes que rodean a los fármacos racémicos y han estimulado mucho debate en la industria, el gobierno y el mundo académico.
Como resultado de estas críticas y de la renovada conciencia de los efectos tridimensionales de la acción de los fármacos, impulsada por la explosión exponencial de la tecnología quiral, surgió la nueva área de la "estereofarmacología". Un término más específico es "farmacología quiral", una frase popularizada por John Caldwell. [26] Este campo se ha convertido en una disciplina especializada que se ocupa de los aspectos tridimensionales de la acción y la disposición de los fármacos. Este enfoque considera esencialmente cada versión de los gemelos quirales como especies químicas separadas. Para expresar las actividades farmacológicas de cada uno de los gemelos quirales se han acuñado dos términos técnicos, eutómero y distómero . [27] El miembro del gemelo quiral que tiene una mayor actividad fisiológica se denomina eutómero y el otro con una actividad menor se denomina distómero. En general, se entiende que esta referencia es necesariamente a una sola actividad que se está estudiando. El eutómero para un efecto puede muy bien ser el distómero cuando se estudia otro. La relación eutómero/distómero se denomina relación eudísmica . [28]
El comportamiento de los gemelos quirales depende principalmente de la naturaleza del entorno (aquiral/quiral) en el que están presentes. Un entorno aquiral no diferencia los gemelos moleculares, mientras que un entorno quiral sí distingue la versión zurda de la versión diestra. El cuerpo humano, un bioambiente clásico, es inherentemente zurdo, ya que está lleno de discriminadores quirales como aminoácidos, enzimas, carbohidratos, lípidos, ácidos nucleicos, etc. Por lo tanto, cuando un agente terapéutico racémico se expone al sistema biológico, los enantiómeros componentes se verán afectados de forma estereoselectiva. [29] En el caso de los fármacos, la discriminación quiral puede tener lugar en la fase farmacocinética o farmacodinámica.
Easson y Stedman [30] (1933) propusieron un modelo de interacción fármaco-receptor para explicar la actividad farmacodinámica diferencial entre pares enantioméricos. En este modelo, el enantiómero más activo (el eutómero) participa en un mínimo de tres interacciones intermoleculares simultáneas con la superficie del receptor (buen ajuste), Figura A., mientras que el enantiómero menos activo (el distómero) interactúa en dos sitios solamente (mal ajuste), Figura B. [Consulte la imagen de la Figura: modelo de Easson-Stedman]. Por lo tanto, el "ajuste" de los enantiómeros individuales al sitio del receptor difiere, al igual que la energía de interacción. Este es un modelo simplista pero se utiliza para explicar la discriminación biológica entre pares enantioméricos.

En realidad, la interacción fármaco-receptor no es tan sencilla, pero esta visión de un fenómeno tan complejo ha proporcionado conocimientos importantes sobre el mecanismo de acción de los fármacos.
Los fármacos racémicos no son combinaciones de fármacos en el sentido aceptado de dos o más agentes terapéuticos coformulados, sino combinaciones de sustancias isoméricas cuya actividad farmacológica puede residir predominantemente en una forma enantiomérica específica. En caso de estereoselectividad en la acción, solo uno de los componentes de la mezcla racémica es verdaderamente activo. El otro isómero, el distómero, debe considerarse como impureza o lastre isomérico, [31] un término acuñado por Ariëns, que no contribuye a los efectos buscados. En contraste con las propiedades farmacocinéticas de un par enantiomérico, las diferencias en la actividad farmacodinámica tienden a ser más obvias. Existe un amplio espectro de posibilidades de acciones del distómero, muchas de las cuales se confirman experimentalmente. [32] [33] [34] En la siguiente tabla se presentan ejemplos seleccionados de las acciones del distómero (a saber, equipotente, menos activo, inactivo, antagónico, inversión quiral ).
Dado que hay grandes diferencias farmacocinéticas y farmacodinámicas frecuentes entre los enantiómeros de un fármaco quiral, no es sorprendente que los enantiómeros puedan dar lugar a una toxicidad estereoselectiva. Pueden residir en el enantiómero farmacológicamente activo (eutómero) o en el inactivo (distómero). [41] [42] [43] También se han demostrado las diferencias toxicológicas entre los enantiómeros de . Los siguientes son ejemplos de algunos de los fármacos quirales donde sus efectos secundarios tóxicos/indeseables residen casi en el distómero. Este parecería ser un caso claro de optar por un cambio quiral .
La penicilamina es un fármaco quiral con un centro quiral y existe como un par de enantiómeros. La (S)-penicilamina es el eutómero con la actividad antiartrítica deseada, mientras que la (R)-penicilamina es extremadamente tóxica. [44]

La ketamina es un agente anestésico ampliamente utilizado. Es una molécula quiral que se administra como un racemato. Los estudios muestran que la (S)-(+)-ketamina es el anestésico activo y que los efectos secundarios no deseados (alucinaciones y agitación) residen en el distómero, (R)-(-)-ketamina. [ 45] [46] [47]

El uso inicial de dopa racémica para el tratamiento de la enfermedad de Parkinson produjo una serie de efectos adversos, como náuseas, vómitos, anorexia, movimientos involuntarios y granulocitopenia. El uso de L-dopa [el enantiómero (S)] redujo la dosis necesaria y los efectos adversos. No se observó granulocitopenia con el enantiómero único. [48] [49] [50]

El agente antituberculoso etambutol contiene dos centros estereogénicos constitucionalmente simétricos en su estructura y existe en tres formas estereoisoméricas. Un par enantiomérico (S,S)- y (R,R)-etambutol, junto con el estereoisómero aquiral llamado forma meso , mantiene una relación diastereomérica con los estereoisómeros ópticamente activos. La actividad del fármaco reside en el enantiómero (S,S)- que es 500 y 12 veces más potente que el (R,R)-etambutol y la forma meso- . El fármaco se había introducido inicialmente para uso clínico como el racemato y se cambió al enantiómero (S,S)-, como resultado de la neuritis óptica que conduce a ceguera. La toxicidad está relacionada tanto con la dosis como con la duración del tratamiento. Los tres estereoisómeros fueron casi equipotentes con respecto a los efectos secundarios. Por lo tanto, el uso del enantiómero S,S)-mejoró en gran medida la relación riesgo/beneficio. [51] [52]
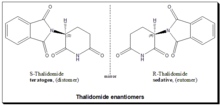
La talidomida es un ejemplo clásico que destaca el supuesto papel de la quiralidad en la toxicidad de los fármacos. La talidomida era un fármaco racémico que se recetaba a mujeres embarazadas para controlar las náuseas y los vómitos. El fármaco se retiró del mercado mundial cuando se hizo evidente que su uso durante el embarazo provoca focomelia (una afección clínica en la que los bebés nacen con manos y extremidades deformadas). Más tarde, a finales de los años 1970, estudios indicaron que el enantiómero (R) es un sedante eficaz , mientras que el enantiómero (S) tiene efectos teratogénicos y provoca anomalías fetales. [53] [54] [55] Estudios posteriores establecieron que, en condiciones biológicas, la ( R) -talidomida, la compañera buena, sufre una inversión metabólica in vivo en la ( S) -talidomida, la compañera mala, y viceversa. Se trata de una inversión quiral bidireccional . Por tanto, el argumento de que la tragedia de la talidomida podría haberse evitado utilizando un único enantiómero es ambiguo y sin sentido. [56] [57] [58]
Las características más destacadas se presentan en la siguiente tabla.
Unichiral indica sustancia homogénea configuracionalmente (es decir, formada por moléculas quirales de una misma configuración). Otros sinónimos de uso común son fármacos enantiopuros y fármacos enantioméricamente puros. También se ha sugerido el término fármacos monoquirales como otro sinónimo. [59] El profesor Eliel, Wilen y Gal expresaron su profunda preocupación por el uso incorrecto del término "homoquiral" en artículos para denotar fármacos enantioméricamente puros, lo cual es incorrecto. [60] [61] [62] Homoquiral significa objetos o moléculas de la misma quiralidad. Por lo tanto, debería usarse solo para comparar dos o más objetos de "quiralidad" similar. Por ejemplo, manos izquierdas de diferentes individuos, o digamos R-naproxeno y R-ibuprofeno.
A nivel mundial, las compañías farmacéuticas y las agencias reguladoras tienen una tendencia hacia el desarrollo de fármacos uniquirales como consecuencia de la mayor comprensión de las diferentes propiedades biológicas de los enantiómeros individuales de una terapia racémica. La mayoría de estos fármacos uniquirales son consecuencia del enfoque de cambio quiral . La siguiente tabla enumera fármacos uniquirales seleccionados que se utilizan en la farmacoterapia.
Una empresa puede dedicarse a desarrollar un fármaco racémico contra un enantiómero proporcionando un razonamiento adecuado. La razón por la que una empresa podría dedicarse a desarrollar fármacos racémicos [63] [64] [65] podría incluir la costosa separación de enantiómeros, el eutómero racemiza en solución (por ejemplo, oxazepam), [66] las actividades del par enantiomérico son diferentes pero complementarias, el distómero es inactivo, pero la separación es exorbitante. Toxicidad insignificante/baja del distómero, alto índice terapéutico, beneficios mutuos, actividades farmacológicas de ambos enantiómeros y si el desarrollo de un enantiómero requiere una gran cantidad de tiempo para un fármaco de necesidad de emergencia, por ejemplo, cáncer, SIDA, etc.
La pureza quiral es una medida de la pureza de un fármaco quiral. Otros sinónimos empleados incluyen exceso enantiomérico , pureza enantiomérica, pureza enantiomérica y pureza óptica. La pureza óptica es un término obsoleto ya que hoy en día la mayoría de las mediciones de pureza quiral se realizan utilizando técnicas cromatográficas (no basadas en principios ópticos). El exceso enantiomérico indica el grado (en %) en el que la sustancia quiral contiene un enantiómero sobre el otro. Para un fármaco racémico, el exceso enantiomérico será del 0%. Hay varias herramientas de análisis quiral como la polarimetría, la espectroscopia de RMN con el uso de reactivos de desplazamiento quiral, la GC quiral (cromatografía de gases), la HPLC quiral (cromatografía líquida de alto rendimiento), la TLC quiral (cromatografía de capa fina) [67] y otras técnicas cromatográficas quirales, que se emplean para evaluar la pureza quiral. [68] Evaluar la pureza de un fármaco uniquiral o enantiopuro es de gran importancia desde la perspectiva de la seguridad y eficacia del fármaco.
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite book}}: Mantenimiento de CS1: otros ( enlace )