La visualización bacteriana (o visualización bacteriana o visualización de superficie bacteriana ) es una técnica de ingeniería de proteínas utilizada para la evolución de proteínas in vitro . Las bibliotecas de polipéptidos que se muestran en la superficie de las bacterias se pueden examinar mediante citometría de flujo o procedimientos de selección iterativos (biopanning). Esta técnica de ingeniería de proteínas nos permite vincular la función de una proteína con el gen que la codifica. La visualización bacteriana se puede utilizar para encontrar proteínas objetivo con las propiedades deseadas y se puede utilizar para crear ligandos de afinidad que sean específicos de la célula. Este sistema se puede utilizar en muchas aplicaciones, incluida la creación de nuevas vacunas, la identificación de sustratos enzimáticos y la búsqueda de la afinidad de un ligando por su proteína objetivo.
La visualización bacteriana a menudo se combina con técnicas de clasificación celular activada magnéticamente (MACS) o clasificación celular activada por fluorescencia (FACS). Los métodos competitivos para la evolución de proteínas in vitro son la visualización de fagos , la visualización de ribosomas , la visualización de levaduras y la visualización de ARNm . La visualización de bacteriófagos es el tipo de sistema de visualización más común utilizado [1], aunque la visualización bacteriana se está volviendo cada vez más popular a medida que se superan los desafíos técnicos. La visualización bacteriana combinada con FACS también tiene la ventaja de que es una técnica en tiempo real.
Los sistemas de visualización celular se utilizaron por primera vez en 1985, cuando los péptidos se fusionaron genéticamente con proteínas mostradas en el bacteriófago M13 . La visualización en bacteriófagos es un sistema de visualización celular de uso común, aunque conlleva limitaciones en el tamaño de las proteínas que se pueden mostrar. La visualización bacteriana se introdujo en 1986, lo que permitió la visualización superficial de proteínas más grandes. Los sistemas de visualización bacteriana fueron introducidos por primera vez por Freudl et al. y Charbit et al. en 1986, cuando utilizaron las proteínas de superficie bacterianas OmpA y LamB para mostrar péptidos. Freudl et al. fusionaron péptidos con enlazadores con el gen ompA , lo que provocó que los péptidos se expresaran en las proteínas OmpA. Demostraron que las proteínas ahora estaban sujetas a escisión por proteinasa K. Por lo tanto, los péptidos no OmpA insertados eran un objetivo de la proteinasa K. La inserción de los péptidos extraños no afectó el crecimiento de células bacterianas. Charbit et al. En primer lugar, definieron las áreas de la proteína LamB que eran "permisivas" para la inserción de péptidos extraños ( es decir , que no conducían a una pérdida completa de la funcionalidad de la proteína). Luego, exploraron la versatilidad de los sitios permisivos (límite de tamaño, naturaleza del epítopo, ...) que estaban todos ubicados en bucles expuestos en la superficie de la porina de la membrana externa trimérica, con el objetivo de desarrollar vacunas bacterianas vivas multivalentes (12-15). Esta fue la primera evidencia del uso de técnicas de visualización de superficie bacteriana para expresar proteínas en la superficie de las células, sin alterar la función de la célula. [2]
Los péptidos son muy útiles como sustancias terapéuticas y de diagnóstico. Su uso es cada vez más popular y los sistemas de visualización ofrecen una forma útil de diseñar péptidos y optimizar sus capacidades de unión. Las células expresan proteínas de superficie que pueden estar involucradas en una gran cantidad de respuestas, incluido el reconocimiento de otras células, la interacción con otras células y la señalización celular . Muchos tipos de bacterias tienen proteínas de superficie celular, como la proteína intimina de E. coli enteropatógena, que está involucrada en la unión a las células huésped, o la proteína OmpA de las células de E. coli , que es importante para mantener la estructura de la membrana externa . [3] Muchas proteínas de superficie están involucradas en la unión celular bacteriana y la invasión de la célula huésped. Al usar la visualización bacteriana, se pueden identificar las proteínas objetivo en la célula huésped. Estas proteínas de superficie primero deben translocarse a través de las membranas celulares bacterianas desde el citoplasma hasta la superficie celular. Las bacterias gramnegativas tienen un espacio periplásmico adicional , del que carecen las bacterias grampositivas , por lo que tienen una tarea más difícil de translocar proteínas. La visualización de proteínas heterólogas en la superficie de la célula bacteriana normalmente requiere la fusión de la proteína con una proteína de superficie, llamada andamio.
Los andamios se utilizan para mostrar la proteína heteróloga en la superficie de la célula bacteriana. Existen varios andamios que se han utilizado, como las proteínas de la membrana externa, las proteínas de las fimbrias/flagelos y CPX (OmpX permutado circularmente). [4] El andamio CPX permite la fusión de péptidos en ambos extremos del andamio.
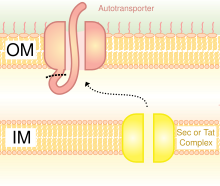
Las OMP son andamios comunes para la visualización bacteriana. Las proteínas también se pueden mostrar en la superficie celular bacteriana mediante el uso de autotransportadores. Los autotransportadores forman parte del sistema de secreción de tipo V. Por lo general, tienen tres dominios: secuencia líder en el N-terminal; dominio pasajero central; dominio autotransportador en el C-terminal. La proteína heteróloga se inserta en el dominio pasajero. [5] Otro método de fusión de proteínas heterólogas es la fusión con fimbrias / flagelos , que son protuberancias filamentosas en la superficie celular. Hay muchas fimbrias principalmente en bacterias Gram-negativas, por lo que mostrar proteínas en fimbrias es ventajoso sobre algunas otras proteínas de superficie que son menos numerosas. Una desventaja de usar fimbrias es que hay un límite de tamaño de inserción relativamente pequeño de 10-30 aminoácidos . [6]

Una vez que la proteína heteróloga se ha fusionado con la proteína de la superficie celular bacteriana, se expone a una enzima , una célula (que expresa una proteína diana) o un anticuerpo (normalmente marcado con fluorescencia ), según la aplicación del experimento. A continuación, la muestra se pasa a través de un haz de luz durante la FACS, en una corriente de fluido muy estrecha de modo que solo pueda pasar una célula a la vez, y se detecta la fluorescencia emitida. Se puede obtener información sobre el tamaño de la célula mediante la dispersión de la luz y, si se ha producido la unión de la proteína heteróloga con la proteína/célula diana, se emitirá más fluorescencia.
La visualización de la superficie bacteriana se puede utilizar para diversas aplicaciones, entre ellas, la detección basada en la afinidad, el mapeo de epítopos de anticuerpos , la identificación de sustratos peptídicos, la identificación de péptidos que se unen a las células y la generación de vacunas. [7]
El cribado se utiliza para encontrar las afinidades aparentes de las proteínas heterólogas que se muestran en la superficie celular bacteriana con las proteínas diana. Este método suele combinarse con FACS, y la adición de un competidor de la proteína diana no fluorescente es beneficiosa para obtener afinidades de unión más precisas. La adición de un competidor reduce la posibilidad de que las proteínas diana se vuelvan a unir, lo que haría que la afinidad de unión fuera menos precisa.
Los péptidos cíclicos se pueden visualizar con éxito en la superficie de las células bacterianas. [8] Mediante la aleatorización del ADN, millones de péptidos cíclicos que se muestran en la superficie celular se pueden analizar en comparación con una proteína objetivo utilizando FACS de alto rendimiento. [9]
El mapeo de epítopos de anticuerpos se utiliza para determinar la especificidad de un anticuerpo. El epítopo (sitio de unión de los anticuerpos a los antígenos) se expresa en la superficie celular bacteriana mediante la expresión de una región del gen que codifica el antígeno. La citometría de flujo con anticuerpos marcados con fluorescencia se utiliza para detectar la cantidad de unión de anticuerpos al epítopo. [10]
Esto se puede aplicar para encontrar los mejores sustratos para las enzimas proteolíticas . El sustrato se muestra en la superficie de la célula bacteriana entre un ligando de afinidad y el andamiaje, y la cinética de la proteólisis del sustrato se mide utilizando FACS.
La visualización bacteriana se puede utilizar para encontrar péptidos que se unen a células específicas, por ejemplo, células de cáncer de mama o células madre . Las proteínas mostradas están marcadas con fluorescencia con GFP , por lo que las interacciones de unión entre los péptidos y las células objetivo se pueden ver mediante citometría de flujo. Se requieren muestras de control para medir los niveles de fluorescencia en ausencia de péptidos mostrados. También se requieren muestras que no contengan péptidos mostrados, pero que contengan células de mamíferos y células bacterianas (incluido el andamiaje).
La administración de vacunas es una aplicación muy común de la exposición de superficies bacterianas. Existen dos tipos de vacunas bacterianas vivas que se pueden elaborar:
El uso de sistemas de presentación de antígenos en la superficie bacteriana es una alternativa valiosa al diseño de vacunas convencionales por varias razones, una de ellas es que las proteínas expresadas en la superficie de la célula bacteriana pueden actuar favorablemente como adyuvante . Las vacunas convencionales requieren la adición de adyuvantes. Otra ventaja de generar vacunas utilizando sistemas de presentación bacteriana es que toda la célula bacteriana puede incorporarse en la vacuna viva [11]. A diferencia de los sistemas de presentación de bacteriófagos que generalmente se utilizan en el desarrollo de vacunas para encontrar epítopos desconocidos, los sistemas de presentación bacteriana se utilizan para expresar epítopos conocidos y las células actúan como un sistema de administración de vacunas. [12]
En condiciones similares, la selección de péptidos expresados en bacterias para modelar la proteína estreptavidina resultó peor. [13]
12. Charbit A, Boulain JC, Ryter A, Hofnung M. Investigación de la topología de una proteína de membrana bacteriana mediante inserción genética de un epítopo extraño; expresión en la superficie celular. EMBO J. 1986 Nov;5(11):3029-37.
13. Charbit A, Sobczak E, Michel ML, Molla A, Tiollais P, Hofnung M. Presentación de dos epítopos de la región preS2 del virus de la hepatitis B en bacterias recombinantes vivas. J Immunol. 1 de septiembre de 1987;139(5):1658-64.
14. Charbit A, Molla A, Saurin W, Hofnung M. Versatilidad de un vector para expresar polipéptidos extraños en la superficie de bacterias gramnegativas. Gene. 15 de octubre de 1988;70(1):181-9.
15. Newton SM, Klebba PE, Michel V, Hofnung M, Charbit A. Topología de la proteína de membrana LamB mediante etiquetado de epítopos y una comparación con el modelo de rayos X. J Bacteriol. 1996 Jun;178(12):3447-56.