

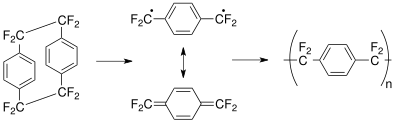
Parileno es el nombre común de un polímero cuya cadena principal está formada por anillos para - bencenodiilo − C
6yo
4− conectados por puentes de 1,2-etanodiilo − CH
2- CH
2−. Puede obtenerse por polimerización de para -xilileno H
2C = C
6yo
4= CH
2.
El nombre también se utiliza para varios polímeros con la misma estructura principal, donde algunos átomos de hidrógeno se sustituyen por otros grupos funcionales . Algunas de estas variantes se designan en el comercio mediante códigos de letras y números, como "parileno C" y "parileno AF-4". Algunos de estos nombres son marcas registradas en algunos países.
Los recubrimientos de parileno se aplican a menudo a circuitos electrónicos y otros equipos como aislamiento eléctrico , barreras de humedad o protección contra la corrosión y el ataque químico ( recubrimiento conformado ). También se utilizan para reducir la fricción y en medicina para prevenir reacciones adversas a dispositivos implantados . Estos recubrimientos se aplican típicamente mediante deposición química de vapor en una atmósfera del monómero para -xilileno.
El parileno se considera un polímero "verde" porque su polimerización no necesita iniciador ni otros productos químicos para terminar la cadena; y los recubrimientos se pueden aplicar a temperatura ambiente o cerca de ella, sin ningún solvente .
El parileno fue descubierto en 1947 por Michael Szwarc como uno de los productos de descomposición térmica del para -xileno H
3C - C
6yo
4- CH
3por encima de 1000 °C. Szwarc identificó al para -xilileno como precursor al observar que la reacción con yodo produjo diyoduro de para-xilileno como único producto. El rendimiento de la reacción fue solo de un pequeño porcentaje. [1] [2]
En 1965, William F. Gorham, de Union Carbide, descubrió una ruta más eficiente: depositó películas de parileno mediante la descomposición térmica de [2,2]paraciclofano a temperaturas superiores a 550 °C y en vacío por debajo de 1 Torr. Este proceso no requería un disolvente y daba como resultado películas resistentes a los productos químicos y sin poros. Union Carbide comercializó un sistema de recubrimiento de parileno en 1965. [1] [2]
Union Carbide continuó investigando la síntesis de numerosos precursores del parileno, incluido el parileno AF-4, durante la década de 1960 y principios de la de 1970. Union Carbide compró NovaTran (una empresa de recubrimiento de parileno) en 1984 y la combinó con otras empresas de recubrimiento químico electrónico para formar la división Specialty Coating Systems. La división se vendió a Cookson Electronics en 1994. [3]
Existen empresas de servicios de recubrimiento de parileno en todo el mundo, pero la disponibilidad comercial de parileno es limitada. Los precursores de [2.2]paraciclofano se pueden comprar para parileno N, C, D, AF-4 y VT-4. Se proporcionan servicios de parileno para N, C, AF-4, VT-4 y E (copolímero de N y E).
El parileno N es el polímero no sustituido obtenido por polimerización del intermedio para -xilileno.

Los derivados del parileno pueden obtenerse reemplazando átomos de hidrógeno en el anillo fenilo o el puente alifático por otros grupos funcionales. La más común de estas variantes es el parileno C, que tiene un átomo de hidrógeno en el anillo arílico reemplazado por cloro . Otra variante común es el parileno D, con dos sustituciones de este tipo en el anillo.
El parileno C es la variedad más utilizada, debido al bajo coste de su precursor y al equilibrio de sus propiedades como barrera dieléctrica y de humedad y facilidad de deposición. Una desventaja importante para muchas aplicaciones es su insolubilidad en cualquier disolvente a temperatura ambiente, lo que impide la eliminación del recubrimiento cuando la pieza tiene que ser retrabajada.
El parileno C también es el más utilizado debido a su costo relativamente bajo. [4] Se puede depositar a temperatura ambiente y al mismo tiempo poseer un alto grado de conformidad y uniformidad y una tasa de deposición moderada en un proceso por lotes.
Además, el cloro en el anillo de fenilo de la unidad de repetición de parileno C es problemático para el cumplimiento de la directiva RoHS , especialmente para la fabricación de placas de circuito impreso . Además, parte del precursor del dímero se descompone al romperse el enlace arilo-cloro durante la pirólisis, lo que genera material carbonoso que contamina el revestimiento y cloruro de hidrógeno HCl que puede dañar las bombas de vacío y otros equipos. El átomo de cloro abandona el anillo de fenilo en el tubo de pirólisis a todas las temperaturas; sin embargo, optimizar la temperatura de pirólisis minimizará este problema. El radical libre (radical fenilo) generado en este proceso no está estabilizado por resonancia y mitiga la deposición de un material similar al parileno en la parte inferior del tubo de pirólisis. Este material se carboniza y genera partículas in situ que contaminan las salas blancas y crean defectos en las placas de circuito impreso que a menudo se denominan "largueros y nódulos". El parileno N y E no tienen este problema y, por lo tanto, son los preferidos para la fabricación y el uso en salas blancas.
Otra variante halogenada común es el parileno AF-4, en el que los cuatro átomos de hidrógeno de la cadena alifática se sustituyen por átomos de flúor . Esta variante también se comercializa con los nombres comerciales de parileno SF (Kisco) y parileno HT (SCS). El − CF
2− La unidad que compone la cadena de etileno es la misma que la unidad repetitiva de PTFE (teflón), lo que le confiere una estabilidad superior frente a la oxidación y los rayos UV. El parileno AF-4 se ha utilizado con éxito para proteger las pantallas LED y la iluminación de exteriores del agua, la sal y los contaminantes.
Otra variante fluorada es el parileno VT-4 (también llamado parileno F), en el que se sustituyen los cuatro hidrógenos del anillo arílico por flúor. Esta variante la comercializa Kisco con la marca comercial Parylene CF. Debido a las unidades alifáticas −CH 2 −, tiene poca estabilidad oxidativa y frente a los rayos UV, pero sigue siendo mejor que N, C o D.
Los átomos de hidrógeno también pueden ser reemplazados por grupos alquilo . La sustitución puede ocurrir en el anillo de fenilo o en el puente de etileno, o en ambos.
Específicamente, la sustitución de un hidrógeno en el anillo de fenilo por un grupo metilo o un grupo etilo produce parileno M y E respectivamente.
Estas sustituciones aumentan la distancia intermolecular (de cadena a cadena), lo que hace que el polímero sea más soluble y permeable. Por ejemplo, en comparación con el parileno C, se demostró que el parileno M tiene una constante dieléctrica más baja (2,48 frente a 3,2 a 1 kHz ). El parileno E tenía un módulo de tracción más bajo ( 175 kpi frente a 460 kpsi [ aclarar ] ), una constante dieléctrica más baja (2,34 frente a 3,05 a 10 kHz), propiedades de barrera de humedad ligeramente peores (4,1 frente a 0,6 g-mil/átomo-100in2-24hr [ aclarar ] ), y una ruptura dieléctrica equivalente de 5-6 kV/ mil para un recubrimiento de 1 mil) pero una mejor solubilidad. [5] [6] Sin embargo, el copolímero de parileno N y E tiene un rendimiento de barrera equivalente al parileno C.
La sustitución de un hidrógeno por metilo en cada carbono del puente etilo produce parileno AM-2, [−(CH
3)CH−(C
6yo
4)−(C
3)CH−]
norte(no debe confundirse con una variante con sustitución de amina registrada por Kisco). La solubilidad del parileno AM-2 no es tan buena como la del parileno E.
Si bien los recubrimientos de parileno se utilizan principalmente para proteger un objeto del agua y otros productos químicos, algunas aplicaciones requieren un recubrimiento que pueda unirse a adhesivos u otras piezas recubiertas, o inmovilizar diversas moléculas como colorantes, catalizadores o enzimas.
Estos recubrimientos de parileno "reactivos" se pueden obtener con sustituyentes químicamente activos. Dos productos disponibles comercialmente son el parileno A, que presenta un sustituyente de amina − NH
2en cada unidad, y parileno AM, con un grupo metilenamina − CH
2NUEVA HAMPSHIRE
2por unidad. Ambas son marcas comerciales de Kisco.
El parileno AM es más reactivo que la variante A. La amina de esta última, al estar adyacente al anillo de fenilo, se encuentra en estabilización por resonancia y, por lo tanto, es menos básica. Sin embargo, el parileno A es mucho más fácil de sintetizar y, por lo tanto, más económico.
Otra variante reactiva es el parileno X, que presenta un grupo etinilo − C≡CH unido al anillo de fenilo en algunas de las unidades. Esta variante, que no contiene otros elementos que hidrógeno y carbono, puede reticularse mediante calor o con luz ultravioleta y puede reaccionar con sales de cobre o plata para generar los complejos metalorgánicos correspondientes Cu-acetiluro o Ag-acetiluro . También puede experimentar " química de clic " y puede usarse como adhesivo , lo que permite la unión de parileno a parileno sin ningún subproducto durante el procesamiento. A diferencia de la mayoría de las otras variantes, el parileno X es amorfo (no cristalino).
Es posible unir un cromóforo directamente a la molécula base [2.2]paraciclofano para impartir color al parileno. [ cita requerida ]
Anteriormente se han depositado copolímeros [7] y nanocompuestos (SiO 2 /parileno C) [8] de parileno a temperatura cercana a la ambiente. Con comonómeros que atraen fuertemente electrones, el parileno se puede utilizar como iniciador para iniciar polimerizaciones, como con N-fenil maleimida . Utilizando los nanocompuestos de parileno C/SiO 2 , el parileno C se podría utilizar como capa de sacrificio para hacer películas delgadas de sílice nanoporosas con una porosidad de >90%. [9]
Las películas delgadas y los recubrimientos de parileno son transparentes; sin embargo, no son amorfos, excepto los parilenos alquilados, es decir, el parileno E. Como resultado, al ser semicristalinos, los recubrimientos dispersan la luz. El parileno N y C tienen un bajo grado de cristalinidad; sin embargo, el parileno VT-4 y AF-4 son altamente cristalinos, aproximadamente un 60 % en su estado original (estructura cristalina hexagonal) y, por lo tanto, generalmente no son adecuados como materiales ópticos.
El parileno C se volverá más cristalino si se calienta a temperaturas elevadas hasta su punto de fusión a 270 °C.
El parileno N tiene una estructura cristalina monoclínica en su estado original y no se vuelve apreciablemente más cristalino hasta que sufre una transformación de fase cristalográfica a ~220 °C a hexagonal, momento en el que se vuelve altamente cristalino como los parilenos fluorados. Puede alcanzar el 80% de cristalinidad a temperaturas de recocido de hasta 400 °C, momento después del cual se degrada.
Los parilenos son relativamente flexibles (0,5 GPa para el parileno N), [10] excepto el parileno X reticulado (1,0 GPa), [11] y tienen poca resistencia oxidativa (~60–100 °C, dependiendo del criterio de falla) y estabilidad UV, [12] excepto el parileno AF-4. Sin embargo, el parileno AF-4 es más caro debido a una síntesis de tres pasos de su precursor con bajo rendimiento y baja eficiencia de deposición. Su estabilidad UV es tan pobre que el parileno no puede exponerse a la luz solar regular sin amarillear.
Casi todos los parilenos son insolubles a temperatura ambiente, excepto los parilenos alquilados, uno de los cuales es el parileno E, [6] y los parilenos etinilados alquilados. [13] Esta falta de solubilidad ha dificultado el retrabajo de placas de circuitos impresos recubiertas con parileno.
Como barrera de difusión de la humedad, la eficacia de los recubrimientos de parileno halogenado aumenta de forma no lineal con su densidad. Los átomos de halógeno como F, Cl y Br añaden mucha densidad al recubrimiento y, por lo tanto, permiten que el recubrimiento sea una mejor barrera de difusión; sin embargo, si se utilizan parilenos como barrera de difusión contra el agua, las químicas apolares como el parileno E son mucho más eficaces. Para las barreras de humedad, los tres parámetros principales del material que se deben optimizar son: densidad del recubrimiento, polaridad del recubrimiento (la química de olefinas es la mejor) y una temperatura de transición vítrea superior a la temperatura ambiente e idealmente superior al límite de servicio de la placa de circuito impreso, el dispositivo o la pieza. En este sentido, el parileno E es la mejor opción, aunque tiene una densidad baja en comparación con, por ejemplo, el parileno C.
Los recubrimientos de parileno se aplican generalmente mediante deposición química de vapor en una atmósfera de monómero para -xilileno o un derivado del mismo. Este método tiene una gran ventaja: no genera ningún subproducto además del polímero de parileno, que debería eliminarse de la cámara de reacción y podría interferir con la polimerización.
Las piezas que se van a recubrir deben estar limpias para garantizar una buena adherencia de la película. Dado que el monómero se difunde, las zonas que no se van a recubrir deben estar selladas herméticamente, sin huecos, grietas u otras aberturas. La pieza debe mantenerse en un margen relativamente estrecho de presión y temperatura. [15]
El proceso implica tres pasos: generación del monómero gaseoso, adsorción en la superficie de la pieza y polimerización de la película adsorbida.
La polimerización del monómero p -xilileno adsorbido requiere una temperatura umbral mínima. Para el parileno N, su temperatura umbral es de 40 °C.
El intermediario p -xilileno tiene dos estados mecánicos cuánticos, el estado benzoide (estado triplete) y el estado quinoide (estado singlete). El estado triplete es efectivamente el iniciador y el estado singlete es efectivamente el monómero. El estado triplete se puede desactivar cuando entra en contacto con metales de transición u óxidos metálicos, incluido Cu/CuO x . [16] [17] Muchos de los parilenos exhiben esta selectividad basada en la desactivación mecánica cuántica del estado triplete, incluido el parileno X.
La polimerización puede proceder por una variedad de rutas que difieren en la terminación transitoria de las cadenas en crecimiento, como un grupo radical − CH•
2o un grupo aniónico negativo CH−
2:

El monómero se polimeriza solo después de ser físicamente adsorbido ( fisisorbido ) en la superficie de la pieza. Este proceso tiene una cinética de Arrhenius inversa , lo que significa que es más fuerte a temperaturas más bajas que a temperaturas más altas. Existe una temperatura umbral crítica por encima de la cual prácticamente no hay fisisorción y, por lo tanto, no hay deposición. Cuanto más cercana esté la temperatura de deposición a la temperatura umbral, más débil será la fisisorción. El parileno C tiene una temperatura umbral más alta, 90 °C, y por lo tanto tiene una velocidad de deposición mucho más alta, mayor de 1 nm /s, al tiempo que produce recubrimientos bastante uniformes. [4] Por el contrario, la temperatura umbral del parileno AF-4 está muy cerca de la temperatura ambiente (30–35 °C), como resultado, su eficiencia de deposición es pobre. [18]
Una propiedad importante del monómero es el denominado "coeficiente de adherencia", que expresa el grado en que se adsorbe en el polímero. Un coeficiente más bajo da como resultado un espesor de deposición más uniforme y un recubrimiento más conforme.
Otra propiedad relevante para el proceso de deposición es la polarizabilidad, que determina la intensidad con la que el monómero interactúa con la superficie. La deposición de parilenos halogenados está estrechamente relacionada con el peso molecular del monómero. Las variantes fluoradas son una excepción: la polarizabilidad del parileno AF-4 es baja, lo que da como resultado una deposición ineficiente.

El monómero de p -xilileno se genera normalmente durante el proceso de recubrimiento evaporando el dímero cíclico [2.2] para - ciclofano a una temperatura relativamente baja, y luego descomponiendo el vapor a 450–700 °C y una presión de 0,01–1,0 Torr . Este método (proceso Gorham) produce un 100% de monómero sin subproductos ni descomposición del monómero. [19] [20] [21]
El dímero se puede sintetizar a partir de p -xileno implicando varios pasos que incluyen bromación , aminación y eliminación de Hofmann . [22]
El mismo método se puede utilizar para depositar parilenos sustituidos. Por ejemplo, el parileno C se puede obtener a partir del precursor dimérico dicloro[2.2] para -ciclofano , excepto que la temperatura debe controlarse cuidadosamente ya que el enlace cloro - arilo se rompe a 680 °C.
El proceso Gorham estándar [5] se muestra arriba para el parileno AF-4. El dímero precursor del octafluoro[2.2] para -ciclofano se puede sublimar por debajo de <100 °C y craquear a 700–750 °C, temperatura más alta que la temperatura (680 °C) utilizada para craquear el ciclofano no sustituido, ya que el enlace −CF 2 −CF 2 − es más fuerte que el enlace −CH 2 −CH 2 −. Este intermedio estabilizado por resonancia se transporta a una cámara de deposición a temperatura ambiente donde se produce la polimerización en condiciones de baja presión (1–100 mTorr). [18]
Otra ruta para la generación del monómero es utilizar un precursor de para -xileno con un sustituyente adecuado en cada grupo metilo , cuya eliminación genera para -xilileno.
La selección de un grupo saliente puede tener en cuenta su toxicidad (que excluye las reacciones basadas en azufre y amina), la facilidad con la que abandona el precursor y la posible interferencia con la polimerización. El grupo saliente puede quedar atrapado antes de la cámara de deposición o puede ser muy volátil para que no se condense en esta última. [23]
Por ejemplo, el precursor α,α'-dibromo-α,α,α',α'-tetrafluoro- para -xileno (CF
2Br)
2(DO
6yo
4) produce parileno AF-4 con eliminación de bromo . [24]
La ventaja de este proceso es el bajo coste de síntesis del precursor. El precursor también es un líquido y se puede suministrar mediante métodos estándar desarrollados en la industria de semiconductores, como con un vaporizador, un vaporizador con burbujeador o un controlador de flujo másico. Originalmente, el precursor solo se craqueaba térmicamente, [25] pero los catalizadores adecuados reducen la temperatura de pirólisis, lo que da como resultado menos residuos de carbón y un mejor recubrimiento. [26] [27] Mediante cualquiera de los métodos , se desprende un radical libre de bromo atómico de cada extremo de metilo, que se puede convertir en bromuro de hidrógeno HBr y eliminar del flujo de monómero. Se necesitan precauciones especiales ya que el bromo y el HBr son tóxicos y corrosivos para la mayoría de los metales y aleaciones metálicas, y el bromo puede dañar las juntas tóricas de vitón .

Una síntesis similar para el parileno N utiliza el precursor α,α'-dimetoxi-p-xileno. [28] El grupo metoxi H
3El CO − es el grupo saliente; mientras se condensa en la cámara de deposición, no interfiere con la deposición del polímero. [23] Este precursor es mucho menos costoso que el [2.2] para -ciclofano. Además, al ser un líquido justo por encima de la temperatura ambiente, este precursor puede administrarse de manera confiable utilizando un controlador de flujo másico ; mientras que la generación y la entrega del monómero gaseoso del proceso Gorham son difíciles de medir y controlar. [29]

La misma química puede generar parileno AM-2 y puede generarse a partir del precursor α,α'-dimetil-α,α'-dimetoxi- p -xileno.

Otro ejemplo de este enfoque es la síntesis de parileno AF-4 a partir de α,α'-difenoxi-α,α,α',α'-tetrafluoro- para -xileno. En este caso, el grupo saliente es fenoxi CH
5O −, que puede condensarse antes de la cámara de deposición. [30]
Los parilenos pueden conferir varias cualidades deseables a las piezas revestidas. Entre otras propiedades, son:
Dado que el proceso de recubrimiento se lleva a cabo a temperatura ambiente en un vacío moderado, se puede aplicar incluso a objetos sensibles a la temperatura, como muestras biológicas secas. La baja temperatura también da como resultado una tensión intrínseca baja en la película delgada. Además, el único gas en la cámara de deposición es el monómero, sin disolventes, catalizadores ni subproductos que puedan atacar el objeto.
El parileno AF-4 y el VT-4 están fluorados y, por lo tanto, son muy caros en comparación con el parileno N y C, lo que ha limitado severamente su uso comercial, excepto para aplicaciones específicas.
El parileno C y, en menor medida, el AF-4, el SF y el HT (todos ellos el mismo polímero) se utilizan para recubrir placas de circuitos impresos (PCB) y dispositivos médicos . Existen muchas otras aplicaciones, ya que el parileno es una excelente barrera contra la humedad. Es el recubrimiento más bioaceptado para stents, desfibriladores, marcapasos y otros dispositivos implantados permanentemente en el cuerpo. [33]
Las químicas clásicas de capas moleculares son monocapas autoensambladas (SAM). Las SAM son cadenas de alquilo de cadena larga, que interactúan con superficies basadas en la interacción azufre-metal (alquiltiolatos) [34] o una reacción de tipo sol-gel con una superficie de óxido hidroxilado (alquiltriclorosilil o trialcoxialquilos). [35] Sin embargo, a menos que la superficie de oro u óxido se trate con cuidado y la cadena de alquilo sea larga, estas SAM forman monocapas desordenadas, que no se empaquetan bien. [36] [37] Esta falta de empaquetamiento causa problemas, por ejemplo, en la fricción estática en dispositivos MEMS . [38]
La observación de que los parilenos podían formar capas moleculares ordenadas (ML) se produjo con mediciones del ángulo de contacto , donde las ML más gruesas de 10 Å tenían un ángulo de contacto de equilibrio de 80 grados (igual que el parileno N en masa), pero las más delgadas tenían un ángulo de contacto reducido. [32] Esto también se confirmó con mediciones eléctricas (mediciones de estrés de temperatura de polarización) utilizando condensadores de metal-aislante-semiconductor (MISCAP). [39] En resumen, el parileno N y el AF-4 (aquellos parilenos sin grupos funcionales) están libres de agujeros de alfiler a ~14 Å. Esto se debe a que las unidades repetidas de parileno poseen un anillo de fenilo y debido a la alta polarizabilidad electrónica del anillo de fenilo, las unidades repetidas adyacentes se ordenan en el plano XY. Como resultado de esta interacción, las ML de parileno son independientes de la superficie, excepto para los metales de transición, que desactivan el estado triplete (benzoide) y, por lo tanto, los parilenos no pueden iniciarse. Este hallazgo de los parilenos como capas moleculares es muy importante para las aplicaciones industriales debido a la robustez del proceso y a que las ML se depositan a temperatura ambiente. De esta manera, los parilenos se pueden utilizar como barreras de difusión y para reducir la polarizabilidad de la superficie (desactivación de superficies de óxido). Combinando las propiedades de los parilenos reactivos con la observación de que pueden formar capas moleculares densas sin poros, el parileno X se ha utilizado como capa de interfaz para la secuenciación del genoma.
Una advertencia con los parilenos de capa molecular es que se depositan como oligómeros y no como polímeros de alto rendimiento. [32] Como resultado, se necesita un recocido al vacío para convertir los oligómeros en polímeros de alto rendimiento. Para el parileno N, esa temperatura es de 250 °C, mientras que es de 300 °C para el parileno AF-4.
Las películas de parileno se han utilizado en diversas aplicaciones, entre ellas [1]
{{cite journal}}: Falta o está vacío |title=( ayuda )