El diazometano es un compuesto químico orgánico de fórmula CH 2 N 2 , descubierto por el químico alemán Hans von Pechmann en 1894. Es el compuesto diazo más simple . En forma pura a temperatura ambiente, es un gas amarillo explosivo extremadamente sensible ; por tanto, se utiliza casi universalmente como solución en éter dietílico . El compuesto es un agente metilante popular en el laboratorio, pero es demasiado peligroso para emplearlo a escala industrial sin precauciones especiales. [4] El uso de diazometano se ha reducido significativamente mediante la introducción del reactivo trimetilsilildiazometano, más seguro y equivalente . [5]
Por seguridad y conveniencia, el diazometano siempre se prepara según sea necesario como una solución en éter y se usa como tal. Convierte los ácidos carboxílicos en ésteres metílicos y los fenoles en sus éteres metílicos . Se cree que la reacción se produce mediante la transferencia de protones del ácido carboxílico al diazometano para dar el catión metildiazonio, que reacciona con el ion carboxilato para dar el éster metílico y el gas nitrógeno. Los estudios de etiquetado indican que la transferencia inicial de protones es más rápida que el paso de transferencia de metilo. [6] Dado que se requiere la transferencia de protones para que la reacción se desarrolle, esta reacción es selectiva para los ácidos carboxílicos más ácidos (p K a ~ 5) y fenoles (p K a ~ 10) sobre los alcoholes alifáticos (p K a ~ 15). . [7]

En aplicaciones más especializadas, el diazometano y sus homólogos se utilizan en la síntesis de Arndt-Eistert y en la reacción de Büchner-Curtius-Schlotterbeck para la homologación. [8] [9]

El diazometano reacciona con alcoholes o fenoles en presencia de trifluoruro de boro (BF 3 ) para dar éteres metílicos .
El diazometano también se utiliza frecuentemente como fuente de carbeno . Participa fácilmente en cicloadiciones 1,3-dipolares .

El diazometano se prepara mediante hidrólisis de una solución etérea de una N -metilnitrosamida con una base acuosa. El precursor tradicional es la N -nitroso- N -metilurea , pero este compuesto es en sí mismo algo inestable, y hoy en día compuestos como la N -metil- N'- nitro- N- nitrosoguanidina (MNNG) y la N -metil- N -nitroso- p Se prefieren -toluenosulfonamida (Diazald) [10] . [11]
CH 2 N 2 reacciona con soluciones básicas de D 2 O para dar el derivado deuterado CD 2 N 2 . [12]
La concentración de CH 2 N 2 se puede determinar de dos maneras convenientes. Puede tratarse con un exceso de ácido benzoico en Et 2 O frío. Luego, el ácido benzoico que no ha reaccionado se vuelve a valorar con NaOH estándar. Alternativamente, la concentración de CH 2 N 2 en Et 2 O se puede determinar espectrofotométricamente a 410 nm, donde su coeficiente de extinción , ε, es 7,2. [ cita necesaria ] La concentración de diazometano en fase gaseosa se puede determinar mediante espectroscopia fotoacústica . [4]
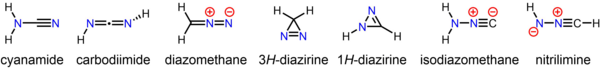
El diazometano es isomérico e isoelectrónico con la cianamida, más estable , pero no pueden interconvertirse. Se han preparado muchos derivados sustituidos del diazometano:
El diazometano es tóxico por inhalación o por contacto con la piel o los ojos (TLV 0,2 ppm). Los síntomas incluyen malestar en el pecho, dolor de cabeza, debilidad y, en casos graves, colapso. [17] Los síntomas pueden retrasarse. Se han informado muertes por intoxicación por diazometano. En un caso, un trabajador de laboratorio consumió una hamburguesa cerca de una campana extractora donde generaba una gran cantidad de diazometano y murió cuatro días después de neumonía fulminante. [18] Como cualquier otro agente alquilante, se espera que sea cancerígeno, pero tales preocupaciones se ven eclipsadas por su grave toxicidad aguda.
El CH 2 N 2 puede explotar en contacto con bordes afilados, como juntas de vidrio esmerilado, e incluso rayones en la cristalería. [19] El material de vidrio debe inspeccionarse antes de su uso y la preparación debe realizarse detrás de una protección contra explosiones. Se encuentran disponibles comercialmente kits especializados para preparar diazometano con juntas pulidas a la llama.
El compuesto explota cuando se calienta a más de 100 °C, se expone a luz intensa, metales alcalinos o sulfato de calcio. Se recomienda encarecidamente el uso de un escudo contra explosiones mientras se utiliza este compuesto.
Se ha realizado un trabajo de prueba de concepto con microfluidos , en el que a la síntesis continua en el punto de uso a partir de N -metil- N- nitrosourea e hidróxido de potasio 0,93 M en agua le siguió la conversión en el punto de uso con ácido benzoico , lo que dio como resultado con un rendimiento del 65 % del éster de benzoato de metilo en cuestión de segundos a temperaturas que oscilan entre 0 y 50 °C. El rendimiento fue mejor que en condiciones capilares; A los microfluidos se les atribuyó la "supresión de puntos calientes, baja retención, condiciones isotérmicas y mezcla intensiva". [20]
El compuesto estable cianamida , cuyo tautómero menor es la carbodiimida , es un isómero del diazometano. Los isómeros del diazometano menos estables pero aún aislables incluyen la 3H - diazirina cíclica y la isocianoamina ( isodiazometano ). [21] [22] Además, la nitrilimina original se ha observado en condiciones de aislamiento de matriz. [23]
{{cite book}}: Mantenimiento CS1: otros ( enlace )