El acoplamiento de Fukuyama es una reacción de acoplamiento que se produce entre un tioéster y un haluro de organocinc en presencia de un catalizador de paladio . El producto de la reacción es una cetona . Esta reacción fue descubierta por Tohru Fukuyama et al. en 1998. [1]
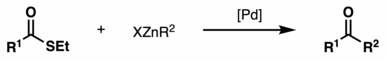
La reacción ha ganado considerable importancia en la química orgánica sintética debido a su alta quimioselectividad , condiciones de reacción suaves y el uso de reactivos menos tóxicos. En particular, el protocolo es compatible con grupos funcionales sensibles como cetonas, α-acetatos, sulfuros, bromuros de arilo, cloruros y aldehídos. Esta excelente quimioselectividad se atribuye a la rápida tasa de formación de cetonas en comparación con la adición oxidativa de paladio a bromuros de arilo o la adición nucleofílica de reactivos de zinc a aldehídos. [1]
Aunque la reacción de acoplamiento cruzado de Fukuyama se ha utilizado ampliamente en la síntesis de productos naturales , el mecanismo de reacción sigue sin estar claro. Se ha demostrado que varios catalizadores promueven la reactividad, incluidos Pd/C, Pd(OH) 2 /C, Pd(OAc) 2 , PdCl 2 , NiCl 2 , Ni(acac) 2 , etc. [2] El ciclo catalítico propuesto que utiliza Pd(OH) 2 /C (catalizador de Pearlman) presenta la generación in situ de Pd/C activo por reducción con un reactivo de zinc o polvo de zinc. [3] Luego, las especies activas de Pd/C se someten a una adición oxidativa con un tioéster, seguida de una transmetalación con un reactivo de zinc y una eliminación reductora , para producir el producto de acoplamiento de cetona .
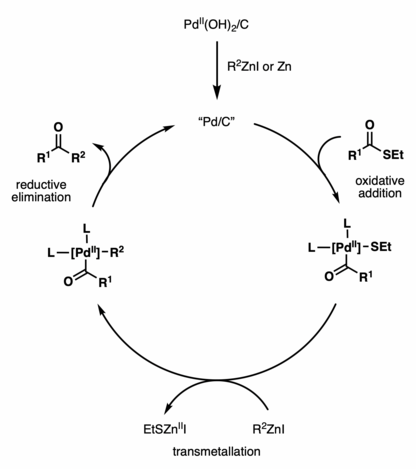
Fukuyama et al. informaron sobre el acoplamiento catalizado por PdCl 2 (PPh 3 ) 2 de tioésteres de etilo con reactivos de organocinc en 1998. [4] Sorprendentemente, las α−aminocetonas a partir de derivados de tioésteres de aminoácidos N-protegidos se pueden sintetizar sin racemización con rendimientos buenos a excelentes (58-88%).

Además del uso de catalizadores de paladio, el primer acoplamiento de Fukuyama catalizado con níquel fue informado por Shimizu y Seki en 2002. [5] Se descubrió que Ni(acac) 2 produce rendimientos superiores en comparación con otros catalizadores de níquel.

En 2004, el mismo grupo de investigadores informó sobre la síntesis de cetonas de Fukuyama catalizada por Pd/C. Esta reacción acopla reactivos de dialquilzinc con varios tioésteres en presencia de bromuro de zinc, que se genera in situ a partir de bromo y polvo de zinc. [6] Los autores propusieron que el bromuro de zinc inactivo se desplaza a la especie activa RZnBr a través del equilibrio de Schlenk . Además, se puede utilizar DMF como aditivo para aumentar los rendimientos de la reacción.

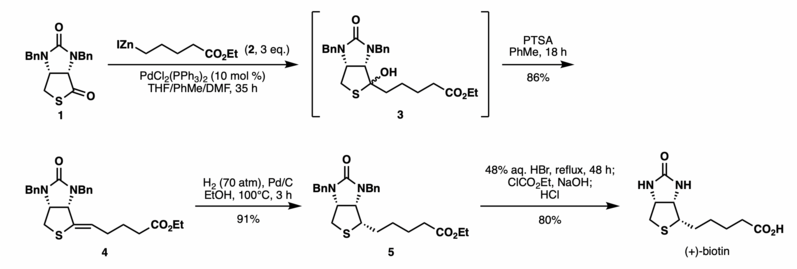
La reacción se ha utilizado para acortar la síntesis de (+)-biotina . [7] Anteriormente, se requería una secuencia larga de seis pasos para instalar la cadena lateral C2 de (+)-biotina al intermedio de tiolactona 1. Shimizu y Seki realizaron la síntesis eficiente de (+)-biotina a través del acoplamiento de Fukuyama de la tiolactona 1 y un reactivo de alquil-cinc fácilmente preparado 2 en presencia de PdCl2 (PPh3)2 catalítico . La reacción generó un alcohol 3 que se hizo reaccionar directamente sin purificación con PTSA para proporcionar el alqueno 4 con un rendimiento del 86 % como un solo isómero. La hidrogenación y una posterior desprotección con bencilo del intermedio de alqueno según el procedimiento informado proporcionaron (+)-biotina con un rendimiento del 73 % en dos pasos. Esta secuencia de acoplamiento de Fukuyama proporcionó (+)-biotina con un rendimiento general del 63 % en tres pasos a partir de la tiolactona 1 , lo que permitió un acceso práctico a la vitamina debido a la secuencia corta, el alto rendimiento, las condiciones suaves y la fácil disponibilidad de los reactivos.
La reacción está relacionada conceptualmente con la reducción de Fukuyama [8] y la reacción de Fukuyama-Mitsunobu. [9]