La especiación de iones se refiere al cambio de concentración de distintas formas de un ión a medida que cambia el pH de la solución . [1]
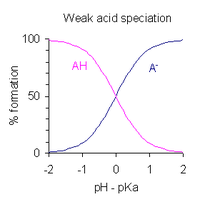
El pH de una solución de un ácido débil monoprótico se puede expresar en términos del grado de disociación. Después de reordenar la expresión que define la constante de disociación ácida y poner pH = −log 10 [H + ], se obtiene
Esta es una forma de la ecuación de Henderson-Hasselbalch . De esta expresión se puede deducir que
De ello se deduce que el rango de pH dentro del cual hay disociación parcial del ácido es aproximadamente p K a ± 2. Esto se muestra gráficamente a la derecha.
Una aplicación práctica de estos resultados es que el rango de transición de pH de un indicador de pH es aproximadamente p K a ± 1; el color del indicador en su forma ácida es diferente del color de la forma de base conjugada. En el rango de transición ambas formas están en equilibrio, por lo que el color es intermedio. Fuera del rango de transición, la concentración de ácido o base conjugada es inferior al 10 % y domina el color de las especies principales.

Un ácido débil puede definirse como un ácido con p K mayor que aproximadamente −2. Un ácido con p K a = −2 estaría 99 % disociado a pH 0, es decir, en una solución de HCl 1 M. Cualquier ácido con ap K a menor que aproximadamente −2 se dice que es un ácido fuerte . Se dice que los ácidos fuertes están completamente disociados. No existe un valor p K preciso que distinga entre ácidos fuertes y débiles porque los ácidos fuertes, como el ácido sulfúrico , están asociados en una solución muy concentrada.
El cálculo de las concentraciones de especies para un ácido poliprótico es más complicado a menos que los valores de p K estén separados por cuatro o más, porque pueden coexistir tres o más especies a un pH dado. El ejemplo del ácido cítrico se muestra a la derecha. Las regiones de pH en las que existen las especies se superponen ampliamente ya que la diferencia entre los valores sucesivos de p K a es pequeña. Se han publicado una gran cantidad de programas informáticos para el cálculo de concentraciones de especies en equilibrio. La mayoría de ellos pueden manejar equilibrios mucho más complicados que los equilibrios ácido-base en solución. Para obtener detalles sobre programas de propósito general, consulte programas de computadora para calcular concentraciones de especies en equilibrio químico .