Una carga superficial es una carga eléctrica presente en una superficie bidimensional. Estas cargas eléctricas están restringidas en esta superficie bidimensional, y la densidad de carga superficial , medida en culombios por metro cuadrado (C•m −2 ), se utiliza para describir la distribución de carga en la superficie. El potencial eléctrico es continuo a través de una carga superficial y el campo eléctrico es discontinuo , pero no infinito; esto es así a menos que la carga superficial consista en una capa dipolar . En comparación, el potencial y el campo eléctrico divergen en cualquier carga puntual o lineal.
En física , en equilibrio, un conductor ideal no tiene carga en su interior; en cambio, toda la carga del conductor reside en la superficie. Sin embargo, esto sólo se aplica al caso ideal de conductividad eléctrica infinita ; la mayor parte de la carga de un conductor real reside dentro de la profundidad de la superficie del conductor. Para materiales dieléctricos , tras la aplicación de un campo eléctrico externo, [1] las cargas positivas y negativas del material se moverán ligeramente en direcciones opuestas, lo que dará como resultado una densidad de polarización en el cuerpo en masa y una carga unida en la superficie.
En química , existen muchos procesos diferentes que pueden llevar a que una superficie se cargue, incluida la adsorción de iones, la protonación o desprotonación y, como se analizó anteriormente, la aplicación de un campo eléctrico externo. La carga superficial emite un campo eléctrico que provoca la repulsión y atracción de las partículas, afectando muchas propiedades coloidales . [2]
La carga superficial prácticamente siempre aparece en la superficie de la partícula cuando se coloca en un fluido . La mayoría de los fluidos contienen iones , positivos ( cationes ) y negativos ( aniones ). Estos iones interactúan con la superficie del objeto. Esta interacción podría provocar la adsorción de algunos de ellos en la superficie. Si el número de cationes adsorbidos excede el número de aniones adsorbidos, la superficie tendría una carga eléctrica neta positiva.
La disociación del grupo químico de la superficie es otro posible mecanismo que conduce a la carga superficial.
La densidad de carga superficial se define como la cantidad de carga eléctrica , q, que está presente en una superficie de un área determinada, A : [3] [ cita completa necesaria ]
Según la ley de Gauss , un conductor en equilibrio al que se le aplica una corriente no tiene carga en su interior. En cambio, la totalidad de la carga del conductor reside en la superficie y puede expresarse mediante la ecuación:
Cuando una superficie se sumerge en una solución que contiene electrolitos , desarrolla una carga superficial neta. Esto suele deberse a la adsorción iónica. Las soluciones acuosas contienen universalmente iones positivos y negativos ( cationes y aniones , respectivamente), que interactúan con cargas parciales en la superficie, adsorbiéndose y, por lo tanto, ionizando la superficie y creando una carga superficial neta. [9] Esta carga neta da como resultado un potencial superficial [L], que hace que la superficie esté rodeada por una nube de contraiones, que se extiende desde la superficie hacia la solución, y también generalmente resulta en repulsión entre partículas. Cuanto mayores son las cargas parciales en el material, más iones se adsorben en la superficie y mayor es la nube de contraiones. Una solución con una mayor concentración de electrolitos también aumenta el tamaño de la nube de contraiones. Esta capa de ion/contraión se conoce como doble capa eléctrica . [10]
El pH de una solución también puede afectar en gran medida la carga superficial porque los grupos funcionales presentes en la superficie de las partículas a menudo pueden contener oxígeno o nitrógeno, dos átomos que pueden protonarse o desprotonarse para cargarse. Así, a medida que cambia la concentración de iones de hidrógeno, también cambia la carga superficial de las partículas. A un determinado pH, la carga superficial media será igual a cero; esto se conoce como punto de carga cero (PZC). [2] A la derecha se muestra una lista de sustancias comunes y sus PZC asociados.
Una interfaz se define como el límite común formado entre dos fases diferentes, como entre un sólido y un gas. [2] El potencial eléctrico , o carga, es el resultado de la capacidad de un objeto de moverse en un campo eléctrico. Un potencial interfacial se define así como una carga ubicada en el límite común entre dos fases (por ejemplo, a un aminoácido como el glutamato en la superficie de una proteína se le puede desprotonar el ácido carboxílico de su cadena lateral en ambientes con un pH superior a 4,1 para producir un aminoácido cargado en la superficie, lo que crearía un potencial interfacial). El potencial interfacial es el responsable de la formación de la doble capa eléctrica, la cual tiene una amplia gama de aplicaciones en lo que se denomina fenómenos electrocinéticos . A continuación se describe el desarrollo de la teoría de la doble capa eléctrica.
El modelo denominado "doble capa eléctrica" fue introducido por primera vez por Hermann von Helmholtz . Se supone que una solución está compuesta únicamente de electrolitos, que no se producen reacciones cerca del electrodo que puedan transferir electrones y que las únicas interacciones de Van der Waals están presentes entre los iones en la solución y el electrodo. Estas interacciones surgen sólo debido a la densidad de carga asociada con el electrodo que surge de un exceso o deficiencia de electrones en la superficie del electrodo. Para mantener la neutralidad eléctrica, la carga del electrodo se equilibrará mediante una redistribución de iones cerca de su superficie. Los iones atraídos forman así una capa que equilibra la carga del electrodo. La distancia más cercana que puede alcanzar un ion al electrodo estará limitada al radio del ion más una única esfera de solvatación alrededor de un ion individual. En general, se observan dos capas de carga y una caída de potencial desde el electrodo hasta el borde de la capa exterior (plano de Helmholtz exterior). Dada la descripción anterior, el modelo de Helmholtz es equivalente en naturaleza a un capacitor eléctrico con dos placas de carga separadas, para el cual se observa una caída de potencial lineal a una distancia creciente de las placas.
El modelo de Helmholtz, si bien es una buena base para la descripción de la interfaz, no tiene en cuenta varios factores importantes: difusión/mezcla en solución, la posibilidad de adsorción en la superficie y la interacción entre los momentos dipolares del disolvente y el electrodo. [11]

La teoría de Gouy-Chapman describe el efecto de una carga superficial estática sobre el potencial de una superficie. [12] " Gouy sugirió que el potencial interfacial en la superficie cargada podría atribuirse a la presencia de varios iones de carga determinada unidos a su superficie, y a un número igual de iones de carga opuesta en la solución". [13] Una carga superficial positiva formará una doble capa, ya que los iones negativos en solución tienden a equilibrar la carga superficial positiva. Los contraiones no se mantienen rígidamente, sino que tienden a difundirse en la fase líquida hasta que el contrapotencial creado por su salida restringe esta tendencia. La energía cinética de los contraiones afectará, en parte, al espesor de la doble capa difusa resultante. La relación entre C, la concentración de contraión en la superficie, y , la concentración de contraión en la solución externa, es el factor de Boltzmann:
Sin embargo, esto es inexacto cerca de la superficie, porque supone que la concentración molar es igual a la actividad. También supone que los iones se modelaron como cargas puntuales y luego se modificaron. Una mejora de esta teoría, conocida como teoría de Gouy-Chapman modificada, incluía el tamaño finito de los iones con respecto a su interacción con la superficie en forma de plano de máxima aproximación. [14]
La relación entre carga superficial y potencial superficial se puede expresar mediante la ecuación de Grahame, derivada de la teoría de Gouy-Chapman asumiendo la condición de electroneutralidad, que establece que la carga total de la doble capa debe ser igual al negativo de la carga superficial. Utilizando la ecuación unidimensional de Poisson y suponiendo que, a una distancia infinitamente grande, el gradiente de potencial es igual a 0, se obtiene la ecuación de Grahame: [2]
Para el caso de potenciales más bajos, se puede expandir a y se define como la longitud de Debye . Lo que lleva a la simple expresión:
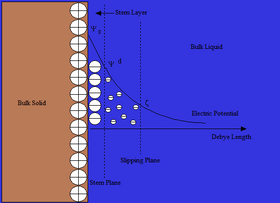
El modelo de doble capa de Otto Stern es esencialmente una combinación de las teorías de Helmholtz y Gouy-Chapman. Su teoría establece que los iones tienen un tamaño finito, por lo que no pueden acercarse a la superficie a menos de unos pocos nanómetros. A través de una distancia conocida como capa Stern, los iones se pueden adsorber en la superficie hasta un punto denominado plano de deslizamiento, donde los iones adsorbidos se encuentran con el líquido a granel. En el plano de deslizamiento el potencial Ψ ha disminuido hasta lo que se conoce como potencial zeta . Aunque el potencial zeta es un valor intermedio, a veces se considera más significativo que el potencial superficial en lo que respecta a la repulsión electrostática. [2]
Las superficies cargadas son extremadamente importantes y se utilizan en muchas aplicaciones. Por ejemplo, las soluciones de partículas coloidales grandes dependen casi por completo de la repulsión debida a la carga superficial para permanecer dispersas. [15] Si estas fuerzas repulsivas se interrumpieran, tal vez mediante la adición de una sal o un polímero, las partículas coloidales ya no podrían mantener la suspensión y posteriormente flocularían . [dieciséis]

Los fenómenos electrocinéticos se refieren a una variedad de efectos resultantes de una doble capa eléctrica . Un ejemplo digno de mención es la electroforesis , donde una partícula cargada suspendida en un medio se mueve como resultado de un campo eléctrico aplicado. [17] La electroforesis se utiliza ampliamente en bioquímica para distinguir moléculas, como las proteínas, según su tamaño y carga. Otros ejemplos incluyen electroósmosis , potencial de sedimentación y potencial de flujo . [2]
Las proteínas suelen tener grupos presentes en sus superficies que pueden ionizarse o desionizarse dependiendo del pH, lo que hace relativamente fácil cambiar la carga superficial de una proteína. Esto tiene ramificaciones particularmente importantes en la actividad de las proteínas que funcionan como enzimas o canales de membrana, principalmente, que el sitio activo de la proteína debe tener la carga superficial adecuada para poder unirse a un sustrato específico. [18]
Las superficies cargadas suelen ser útiles para crear superficies que no adsorberán ciertas moléculas (por ejemplo, para evitar la adsorción de proteínas básicas, se debe usar una superficie cargada positivamente). Los polímeros son muy útiles a este respecto porque pueden funcionalizarse de modo que contengan grupos ionizables, que sirven para proporcionar una carga superficial cuando se sumergen en una solución acuosa. [19]
{{citation}}: Falta o está vacío |title=( ayuda )