

El fósforo elemental puede existir en varios alótropos , los más comunes de los cuales son los sólidos blancos y rojos . También se conocen alótropos sólidos violetas y negros. El fósforo gaseoso existe como difósforo y fósforo atómico.

El fósforo blanco , fósforo amarillo o simplemente tetrafósforo ( P4 ) existe como moléculas de cuatro átomos de fósforo en una estructura tetraédrica, unidos por seis enlaces simples fósforo-fósforo . La disposición tetraédrica da como resultado tensión e inestabilidad en el anillo. [ 1]
El fósforo blanco fundido y gaseoso también retiene las moléculas tetraédricas, hasta los 800 °C (1.500 °F; 1.100 K) cuando comienza a descomponerse en P
2moléculas. [2]
El fósforo blanco es un sólido ceroso translúcido que amarillea rápidamente con la luz, y por eso el fósforo blanco impuro se llama fósforo amarillo. Es tóxico y provoca graves daños al hígado si se ingiere y fósil en caso de ingestión o inhalación crónicas.
El fósforo blanco brilla de un color verdoso en la oscuridad (cuando se expone al oxígeno). Se enciende espontáneamente en el aire a unos 50 °C (122 °F), y a temperaturas mucho más bajas si se divide finamente (debido a la depresión del punto de fusión ). Debido a esta propiedad, el fósforo blanco se utiliza como arma . El fósforo reacciona con el oxígeno, formando normalmente dos óxidos dependiendo de la cantidad de oxígeno disponible: P 4 O 6 ( trióxido de fósforo ) cuando reacciona con un suministro limitado de oxígeno, y P 4 O 10 cuando reacciona con un exceso de oxígeno. En raras ocasiones, también se forman P 4 O 7 , P 4 O 8 y P 4 O 9 , pero en pequeñas cantidades. Esta combustión da lugar al óxido de fósforo (V), que consiste en P 4 O 10 tetraédrico con oxígeno insertado entre los átomos de fósforo y en sus vértices:
El olor de la combustión de esta forma tiene un característico olor a ajo. El fósforo blanco es sólo ligeramente soluble en agua y puede almacenarse bajo el agua. De hecho, el fósforo blanco es seguro contra la autoignición cuando se sumerge en agua; debido a esto, el fósforo blanco sin reaccionar puede resultar peligroso para los recolectores de tesoros que pueden recoger muestras arrastradas por la marea sin ser conscientes de su verdadera naturaleza. [3] [4] El P 4 es soluble en benceno , aceites , disulfuro de carbono y dicloruro de disulfuro .
El alótropo blanco se puede producir utilizando varios métodos. En el proceso industrial, la roca fosfórica se calienta en un horno eléctrico o de combustible en presencia de carbono y sílice . [5] El fósforo elemental se libera luego como vapor y se puede recolectar bajo ácido fosfórico . Se muestra una ecuación idealizada para esta reacción carbotérmica para el fosfato de calcio (aunque la roca fosfórica contiene cantidades sustanciales de fluoroapatita ):
Aunque el fósforo blanco forma el tetraedro , el hidrocarburo platónico más simple posible , no se conocen otros grupos poliédricos de fósforo. [6] El fósforo blanco se convierte en el alótropo rojo, termodinámicamente más estable, pero ese alótropo no es un poliedro aislado.
En particular, es poco probable que se forme Cubane , [6] y el enfoque más cercano es el compuesto de semifósforo P 4 (CH) 4 , producido a partir de fosfaalquinos . [7] Otros grupos son más favorables termodinámicamente y algunos se han formado parcialmente como componentes de compuestos polielementales más grandes. [6]

El fósforo rojo se puede formar calentando fósforo blanco a 300 °C (570 °F) en ausencia de aire o exponiéndolo a la luz solar . El fósforo rojo existe como una red amorfa . Al calentarse más, el fósforo rojo amorfo cristaliza. Tiene dos formas cristalinas: fósforo violeta y fósforo rojo fibroso . El fósforo rojo a granel no se enciende en el aire a temperaturas inferiores a 240 °C (460 °F), mientras que los trozos de fósforo blanco se encienden a unos 30 °C (86 °F).
En condiciones estándar, es más estable que el fósforo blanco, pero menos estable que el fósforo negro, termodinámicamente estable. La entalpía estándar de formación del fósforo rojo es de -17,6 kJ/mol. [1] El fósforo rojo es cinéticamente más estable.
Fue presentada por primera vez por Anton von Schrötter ante la Academia de Ciencias de Viena el 9 de diciembre de 1847, aunque sin duda otros ya habían tenido esta sustancia en sus manos antes, como Berzelius. [8]
El fósforo rojo se puede utilizar como un retardante de llama muy eficaz , especialmente en termoplásticos (por ejemplo, poliamida ) y termoestables (por ejemplo, resinas epoxi o poliuretanos ). El efecto retardante de llama se basa en la formación de ácido polifosfórico . Junto con el material polimérico orgánico, estos ácidos crean un carbón que impide la propagación de las llamas. Los riesgos de seguridad asociados con la generación de fosfina y la sensibilidad a la fricción del fósforo rojo se pueden minimizar de manera efectiva mediante la estabilización y la microencapsulación . Para un manejo más fácil, el fósforo rojo se utiliza a menudo en forma de dispersiones o masterbatches en varios sistemas portadores. Sin embargo, para sistemas electrónicos/eléctricos, el retardante de llama de fósforo rojo ha sido prohibido de manera efectiva por los principales OEM debido a su tendencia a inducir fallas prematuras. [9] Un problema persistente es que el fósforo rojo en compuestos de moldeo de epoxi induce una corriente de fuga elevada en dispositivos semiconductores. [10] Otro problema fue la aceleración de las reacciones de hidrólisis en el material aislante PBT . [11]
El fósforo rojo también puede utilizarse en la producción ilícita de metanfetamina y Krokodil .
El fósforo rojo se puede utilizar como fotocatalizador elemental para la formación de hidrógeno a partir del agua. [12] Presentan una tasa de evolución de hidrógeno constante de 633 μmol/(h⋅g) mediante la formación de fósforo fibroso de tamaño pequeño. [13]



El fósforo monoclínico , fósforo violeta o fósforo metálico de Hittorf es una forma cristalina del fósforo rojo amorfo . [14] [15] En 1865, Johann Wilhelm Hittorf calentó fósforo rojo en un tubo sellado a 530 °C. La parte superior del tubo se mantuvo a 444 °C. Como resultado, se sublimaron cristales monoclínicos o romboédricos opacos brillantes . El fósforo violeta también se puede preparar disolviendo fósforo blanco en plomo fundido en un tubo sellado a 500 °C durante 18 horas. Tras un enfriamiento lento, el alótropo de Hittorf cristaliza . Los cristales se pueden revelar disolviendo el plomo en ácido nítrico diluido seguido de ebullición en ácido clorhídrico concentrado . [16] Además, existe una forma fibrosa con jaulas de fósforo similares. La estructura reticular del fósforo violeta fue presentada por Thurn y Krebs en 1969. [17] Se obtuvieron frecuencias imaginarias, que indican las irracionalidades o inestabilidades de la estructura, para la estructura violeta reportada en 1969. [18] También se produjo el monocristal de fósforo violeta. La estructura reticular del fósforo violeta se obtuvo mediante difracción de rayos X de monocristal y resultó ser monoclínica con un grupo espacial de P 2/ n (13) ( a = 9,210, b = 9,128, c = 21,893 Å, β = 97,776°, CSD-1935087). La brecha de banda óptica del fósforo violeta se midió mediante espectroscopia de reflectancia difusa y resultó ser de alrededor de 1,7 eV. La temperatura de descomposición térmica fue 52 °C más alta que la de su contraparte de fósforo negro. El fosforeno violeta se obtiene fácilmente mediante exfoliación mecánica y en solución.
El fósforo violeta no se enciende en el aire hasta que se calienta a 300 °C y es insoluble en todos los disolventes. No es atacado por los álcalis y sólo reacciona lentamente con los halógenos . Puede oxidarse con ácido nítrico a ácido fosfórico . El fósforo violeta se enciende al impactar en el aire. [19] [ se necesita una mejor fuente ]
Si se calienta en una atmósfera de gas inerte, por ejemplo nitrógeno o dióxido de carbono , se sublima y el vapor se condensa en forma de fósforo blanco. Si se calienta en vacío y el vapor se condensa rápidamente, se obtiene fósforo violeta. Parecería que el fósforo violeta es un polímero de alta masa molecular relativa, que al calentarse se descompone en moléculas de P2 . Al enfriarse, estas normalmente se dimerizarían para dar moléculas de P4 (es decir, fósforo blanco) pero, en vacío , se vuelven a unir para formar el alótropo violeta polimérico.


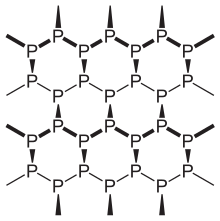
El fósforo negro es la forma termodinámicamente estable del fósforo a temperatura y presión ambiente , con un calor de formación de −39,3 kJ/mol (en relación con el fósforo blanco, que se define como el estado estándar). [1] Se sintetizó por primera vez calentando fósforo blanco a altas presiones (12 000 atmósferas) en 1914. Como material 2D, en apariencia, propiedades y estructura, el fósforo negro es muy parecido al grafito , ya que es negro y escamoso, un conductor de electricidad y tiene láminas fruncidas de átomos enlazados. [20]
El fósforo negro tiene una estructura de panal plisado ortorrómbico y es el alótropo menos reactivo, resultado de su red de anillos interconectados de seis miembros donde cada átomo está unido a otros tres átomos. [21] [22] En esta estructura, cada átomo de fósforo tiene cinco electrones en la capa externa. [23] El fósforo negro y rojo también pueden adoptar una estructura de red cristalina cúbica . [24] La primera síntesis a alta presión de cristales de fósforo negro fue realizada por el ganador del premio Nobel Percy Williams Bridgman en 1914. [25] Las sales metálicas catalizan la síntesis de fósforo negro. [26]
Los sensores basados en fósforo negro presentan varias cualidades superiores a las de los materiales tradicionales utilizados en sensores piezoeléctricos o resistivos. El fósforo negro, que se caracteriza por su exclusiva estructura reticular en forma de panal, proporciona una movilidad excepcional de los portadores. Esta propiedad garantiza su alta sensibilidad y resiliencia mecánica, lo que lo convierte en un candidato interesante para la tecnología de sensores . [27] [28]
Las similitudes con el grafito también incluyen la posibilidad de delaminación con cinta adhesiva (exfoliación), lo que resulta en fosforeno , un material 2D similar al grafeno con excelentes propiedades de transporte de carga, propiedades de transporte térmico y propiedades ópticas. Las características distintivas de interés científico incluyen un intervalo de banda dependiente del espesor, que no se encuentra en el grafeno. [29] Esto, combinado con una alta relación de encendido/apagado de ~10 5 hace que el fosforeno sea un candidato prometedor para transistores de efecto de campo (FET). [30] El intervalo de banda ajustable también sugiere aplicaciones prometedoras en fotodetectores de infrarrojo medio y LED. [31] [32] El fósforo negro exfoliado sublima a 400 °C en vacío. [33] Se oxida gradualmente cuando se expone al agua en presencia de oxígeno, lo que es una preocupación cuando se lo contempla como material para la fabricación de transistores, por ejemplo. [34] [35] El fósforo negro exfoliado es un material de ánodo emergente en la comunidad de baterías, que muestra alta estabilidad y almacenamiento de litio . [36]
El fósforo en forma de anillo se predijo teóricamente en 2007. [37] El fósforo en forma de anillo se autoensambló dentro de nanotubos de carbono de paredes múltiples evacuados con diámetros internos de 5-8 nm utilizando un método de encapsulación de vapor. Se observó un anillo con un diámetro de 5,30 nm, que consta de 23 unidades P 8 y 23 P 2 con un total de 230 átomos de P, dentro de un nanotubo de carbono de paredes múltiples con un diámetro interno de 5,90 nm en escala atómica. La distancia entre anillos vecinos es de 6,4 Å. [38]
La molécula en forma de anillo P6 no es estable de forma aislada.
El fósforo azul de una sola capa se produjo por primera vez en 2016 mediante el método de epitaxia de haz molecular a partir de fósforo negro como precursor. [39]


El alótropo difósforo ( P 2 ) normalmente se puede obtener solo en condiciones extremas (por ejemplo, a partir de P 4 a 1100 kelvin). En 2006, la molécula diatómica se generó en solución homogénea en condiciones normales con el uso de complejos de metales de transición (por ejemplo, tungsteno y niobio ). [40]
El difósforo es la forma gaseosa del fósforo y es termodinámicamente estable entre 1200 °C y 2000 °C. La disociación del tetrafósforo ( P 4 ) comienza a temperaturas más bajas: el porcentaje de P 2 a 800 °C es ≈ 1%. A temperaturas superiores a unos 2000 °C, la molécula de difósforo comienza a disociarse en fósforo atómico.
Los polímeros nanobarra P 12 se aislaron de los complejos CuI-P mediante un tratamiento a baja temperatura. [41]
Se ha demostrado que el fósforo rojo/marrón es estable en el aire durante varias semanas y tiene propiedades distintas a las del fósforo rojo. La microscopía electrónica mostró que el fósforo rojo/marrón forma nanobarras paralelas y largas con un diámetro de entre 3,4 Å y 4,7 Å. [41]