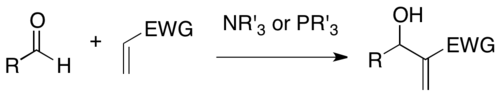
En química orgánica , la reacción de Baylis–Hillman , Morita–Baylis–Hillman o MBH es una reacción de formación de enlaces carbono-carbono entre un alqueno activado y un electrófilo de carbono en presencia de un catalizador nucleofílico , como una amina terciaria o una fosfina . El producto está densamente funcionalizado , uniendo el alqueno en la posición α a una forma reducida del electrófilo (por ejemplo, en el caso de un aldehído , un alcohol alílico ). [1] [2]
La reacción debe su nombre a Anthony B. Baylis y Melville E. D. Hillman, dos de los químicos que desarrollaron la reacción en Celanese ; y a K. Morita, quien publicó trabajos anteriores [3] sobre el mismo.
La reacción MBH ofrece varias ventajas en la síntesis orgánica :
Su desventaja es que la reacción es extremadamente lenta.
El catalizador más utilizado para la reacción es la amina terciaria DABCO (trietilendiamina) ; otros catalizadores conocidos incluyen 4-dimetilaminopiridina , DBU (diazabicicloundeceno) y varias fosfinas .
A partir de 2012 [update], ciertas preguntas sobre el mecanismo de reacción de MBH permanecen abiertas.
Hill e Isaacs realizaron los primeros experimentos cinéticos en la década de 1990, descubriendo que la velocidad de reacción entre el acrilonitrilo y el acetaldehído era de primer orden en cada reactivo y en el catalizador DABCO. El acrilonitrilo α -deuterado no exhibió ningún efecto isotópico cinético , pero el producto pareció catalizar su propia generación . [4]
En un modelo propuesto por Hoffmann siete años antes, [5] la reacción comienza con la adición 1,4 de la amina catalítica al alqueno activado. El azaenolato zwitteriónico resultante sufre una adición aldólica al aldehído. El desplazamiento intramolecular de protones genera entonces el aducto final de MBH, que elimina el catalizador.

Si el modelo de Hoffmann fuera correcto, entonces la adición aldólica sería el paso limitante de la velocidad , lo que concuerda con el efecto isotópico cinético ausente. [4] Sin embargo, el mecanismo de Hoffmann no racionaliza ni la autocatálisis del producto ni (en la reacción de aldehídos arílicos con acrilatos ) la considerable generación de un subproducto de dioxanona .
En trabajos más recientes, McQuade et al y Aggarwal et al reevaluaron el mecanismo MBH, centrándose en la transferencia de protones y la autocatálisis. [6] [7] Según McQuade, la reacción entre el acrilato de metilo y el p-nitrobenzaldehído es de segundo orden en relación con el aldehído. Además, mostró un efecto isotópico cinético significativo para el α-hidrógeno del acrilato (5,2 en DMSO , pero ≥2 en todos los disolventes), lo que implicaría que la abstracción de protones es el paso determinante de la velocidad.
Para explicar este nuevo análisis, McQuade propuso modificar la propuesta de Hoffman, de modo que después de la primera adición aldólica, se añada una segunda para formar un alcóxido hemiacetal. Luego, la transferencia de protones que determina la velocidad libera el aducto A a través de un estado de transición de seis miembros , que reacciona posteriormente para producir el producto MBH B o un subproducto de dioxanona C.
En una modificación posterior, Aggarwal señaló que observó que el metanol inhibía la autocatálisis en la reacción de MBH. Por lo tanto, propuso que en las primeras etapas de la reacción, opera un mecanismo equivalente a la propuesta de McQuade, pero después del 20% de conversión, la reacción con un disolvente alcohólico puede reemplazar la segunda adición aldólica. En apoyo de esta afirmación, Aggarwal y Harvey modelaron las dos vías utilizando cálculos de la teoría funcional de la densidad y demostraron que el perfil de energía calculado coincide con los efectos isotópicos cinéticos experimentales y la velocidad de reacción observada. [8] También demostraron que la barrera entálpica general de la vía catalizada por alcohol es ligeramente menor que la de la vía no catalizada por alcohol, racionalizando que a medida que aumenta la concentración de alcohol (producto de MBH), la vía catalizada por alcohol comienza a dominar.

Si bien los estudios de McQuade y Aggarwal recibieron mucha atención, en 2012 no se había podido demostrar de manera inequívoca el papel del intermediario A.[update] Como A se podía formar mediante la adición separada de B a un aldehído, cualquier A y C aislados podrían ser el resultado de reacciones secundarias , en lugar del propio MBH. Tampoco se ha presentado aún una explicación convincente para los datos originales de primer orden de Hill e Isaac.
La modificación de Aggarwal tiene sus propias controversias. Si es correcta, entonces el paso que determina la velocidad cambia de la transferencia de protones a la adición aldólica a lo largo de la reacción [7] , pero estudios computacionales posteriores han concluido que la transferencia de protones sigue teniendo la barrera más alta incluso en etapas avanzadas del proceso de reacción. Por otro lado, Coelho y Eberlin et al. han obtenido datos de electrospray ( espectroscopia de masas ) que son evidencia estructural de dos formas diferentes del paso de transferencia de protones de la reacción. [9]

La reacción MBH es extremadamente general. En la mayoría de los casos, el electrófilo es un aldehído, una cetona (pero véase más adelante) o una imina (últimamente, la reacción aza -Baylis–Hillman ); pero los informes indican que también son posibles los haluros de alilo , los haluros de alquilo y los epóxidos . [10] [11] [12] El uso de un aleno en lugar de un alqueno simple como precursor da un intermedio que puede reaccionar en el carbono γ en lugar de en el α. [13]
Al mismo tiempo, puede resultar complicado desarrollar condiciones de reacción adecuadas. La reacción es lenta ( no son raros los tiempos de quince días o más, incluso con un catalizador de 25-100 mol %), especialmente con olefinas activadas β-sustituidas (como alqueno), vinilsulfonas o vinilsulfóxidos ; o (como electrófilos) aldehídos alifáticos impedidos o benzaldehídos ricos en electrones . Las cetonas generalmente no son lo suficientemente reactivas en condiciones ordinarias para participar de una manera sintéticamente útil. [14] Por ejemplo, la reacción entre acrilato de t - butilo estéricamente impedido y benzaldehído con DABCO catalítico en ausencia de disolvente requirió 4 semanas para dar una conversión moderada al producto final.

En disolventes apróticos, la velocidad de reacción es aún más lenta, aunque la recuperación es posible con aditivos próticos (por ejemplo, alcoholes y ácidos carboxílicos). [15]
A velocidades tan bajas, la actividad de los sustratos puede inducir reacciones secundarias competitivas: las acroleínas también oligomerizan y los alenoatos forman cicloadd. Los electrófilos de haluro de alilo y epóxido de alquilo también suelen resultar rebeldes. [ aclaración necesaria ] [ cita necesaria ] La reacción MBH de una arilvinilcetona con un aldehído no es sencilla (pero véase § Reacción Sila-MBH), ya que la arilvinilcetona reactiva sufre fácilmente la adición de Michael a otra molécula de la arilvinilcetona, que luego se añade al aldehído para formar un aducto doble-MBH. [16]

Debido al volumen de activación altamente negativo, se pueden lograr reacciones lentas de Baylis-Hillman, incluidas las cetónicas, al llevar a cabo la reacción bajo alta presión (hasta 20 kbar). [14]
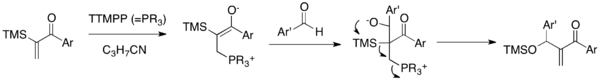
En la reacción sila-MBH , las cetonas de arilo vinílico α-sililadas se acoplan a aldehídos en presencia de TTMPP catalítico , un reactivo de fosfina de triarilo grande. [17] El enolato zwitteriónico producido tras la adición de catalizador nucleofílico a la enona se suma a un carbonilo de aldehído para generar un alcóxido. Este alcóxido sufre una posterior reorganización de 1,3-Brook y una cascada de eliminación para producir una siloxi-metilen enona y liberar el catalizador.

La reacción de Rauhut-Currier es un análogo vinílogo de la reacción MBH, en la que el electrófilo es un aceptor de Michael , no un aldehído o una imina. Las reacciones intermoleculares de Rauhut-Currier suelen mostrar una quimioselectividad deficiente , porque la reacción acopla dos alquenos activados, pero se han empleado reacciones intramoleculares de Rauhut-Currier. Por ejemplo, la ciclización de aldehídos α,β-insaturados se puede realizar en presencia de un derivado de prolina y ácido acético, lo que produce productos enantioenriquecidos. [18]
Como se mencionó anteriormente, la velocidad lenta de la reacción de MBH a menudo permite reacciones secundarias en sus sustratos activados. En las estrategias de reacción en tándem , esto es una virtud, ya que permite síntesis con una alta economía de átomos. Por ejemplo, en el acoplamiento de tres componentes de aldehídos, aminas y alquenos activados, el aldehído reacciona con la amina para producir una imina antes de formar el aducto aza -MBH, como en la reacción de aldehídos arílicos , difenilfosfinamida y metilvinilcetona , en presencia de TiCl4 , trifenilfosfina y trietilamina : [19]

De la misma manera, los acetilenos activados pueden sufrir adición conjugada y permanecer como un alqueno activado para la reacción de MBH, como en la siguiente reacción de ciclización enantioselectiva en la que un nucleófilo fenolato se agrega a un enino funcionalizado antes del cierre del anillo aza -MBH catalizado por una base de amina quiral. [20]

El sultam de Oppolzer se puede utilizar como auxiliar quiral para una reacción de MBH asimétrica. Cuando un acrilato sustituido con el sultam de Oppolzer reaccionó con varios aldehídos en presencia del catalizador DABCO, se obtuvieron 1,3-dioxan-4-onas ópticamente puras con escisión del auxiliar (rendimiento del 67-98 %, >99 % ee). Los productos cíclicos se pudieron convertir en los productos de MBH deseados mediante el uso de ácido canforsulfónico y metanol. [21]
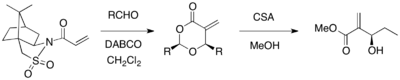
Un auxiliar de hidrazida relacionado es la acriloilhidrazida quiral, que reacciona diastereoselectivamente con aldehídos. [22] Ambos diastereómeros podrían obtenerse con diferentes opciones de solventes (DMSO vs. THF y H2O mixtos ) , lo que sugiere que la conformación de la estructura de transición está influenciada por el solvente.
También se pueden emplear alenos e iminas quirales para una reacción aza -MBH catalizada por DABCO asimétrica. [23] El buta-2,3-dienoato de 10-fenilsulfonilisobornilo ópticamente activo reacciona con una aril imina para producir α-allenilamina de manera diastereoselectiva (rendimiento del 37-57%).

Algunas reacciones enantioselectivas de MBH emplean catalizadores de amina terciaria quirales. Por ejemplo, el β-ICD, un derivado del alcaloide de la quina, es famoso entre los catalizadores basados en la estructura de la quinidina y catalizó una reacción enantioselectiva de MBH con acrilato de 1,1,1,3,3,3,-hexafluoroisopropilo como alqueno activado: [24]
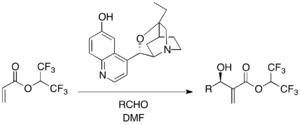
Se demostró que el oxígeno fenólico del β-ICD es importante en la reacción, lo que implica que el β-ICD actúa como un ácido de Bronsted, no solo como un nucleófilo.
La ciclopentenona y varios aldehídos aromáticos y alifáticos experimentan una reacción asimétrica utilizando el catalizador DMAP quiral planar de Fu en isopropanol (rendimiento del 54-96 %, ee del 53-98 %). En este caso, se requirió yoduro de magnesio como cocatalizador de ácido de Lewis para acelerar la reacción. [25]

Se han investigado las fosfinas P -quirales. [26]
También se pueden emplear diaminas simples como catalizadores de MBH. Se descubrió que la metilvinilcetona y varios benzaldehídos sustituidos experimentan una reacción de MBH asimétrica. El catalizador de pirrolidina quiral fue eficaz para benzaldehídos deficientes en electrones orto- y para-sustituidos (rendimiento del 75-99 %, ee del 8-73 %). [27]

Los catalizadores de fosfina quirales MBH a menudo contienen fracciones de ácido de Bronsted en sus cadenas principales. Por ejemplo, se desarrollaron fosfinas quirales que contienen una base de Lewis, un ácido de Bronsted y una base de Bronsted activada por ácido para una reacción aza -MBH asimétrica (rendimiento del 86-96 %, ee del 79-92 %). Se propuso que las fracciones de ácido y base de Bronsted estuvieran involucradas en la estabilización de especies zwitteriónicas de manera estereoselectiva. [28]

El catalizador de fosfina quiral derivado de BINOL también es eficaz para una reacción aza-MBH asimétrica de N-tosil iminas con alquenos activados como metil vinil cetona y acrilato de fenilo. [29]
Además, una clase distinta de moléculas de fosfina- esquaramida quirales podrían catalizar eficazmente una reacción intramolecular asimétrica de MBH. Las ω-formilenonas reaccionaron para producir productos cíclicos enantioenriquecidos a temperatura ambiente (rendimiento del 64-98 %, ee del 88-93 %). [30]

Los catalizadores de ácido Lewis quirales han despertado interés debido a que pueden activar el grupo atractor de electrones de manera enantioselectiva. Se ha demostrado que los catalizadores de oxazaborolidinio catiónicos quirales son eficaces en el acoplamiento de tres componentes de ésteres α,β-acetilénicos, aldehídos y yoduro de trimetilsililo (rendimiento del 50-99 %, ee del 62-94 %). Ambos productos enantioméricos se pueden obtener utilizando diferentes enantiómeros del catalizador. [31]

El complejo de sal metálica y ligando quiral también es una estrategia viable. Los ligandos quirales derivados de La(OTf) 3 y alcanfor podrían inducir enantioselectividad en una reacción de MBH catalizada por DABCO de varios aldehídos y acrilatos (rendimiento del 25-97 %, ee del 6-95 %). Para estos casos, se emplearon generalmente ligandos multidentados para quelar con el metal, lo que activa tanto el enolato zwitteriónico como el aldehído. [32]

El sistema de ligando derivado de La(O-iPr) 3 y BINOL, junto con el DABCO catalítico, también funciona para una reacción aza-MBH asimétrica de varias iminas de N-difenilfosfinoilo y acrilato de metilo. Las iminas de arilo, heteroarilo y alquenilo resultaron adecuadas para un buen rendimiento y enantioselectividad. [33]
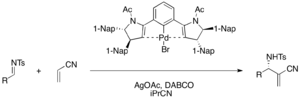
Los complejos de pinza de paladio(II) quirales funcionan como ácido de Lewis en la reacción aza-MBH catalizada por DABCO enantioselectiva de acrilonitrilo y varias iminas de tosil para producir α-metilen-β-aminonitrilos funcionalizados (rendimiento del 75-98 %, ee del 76-98 %). Se requiere acetato de plata para activar el precatalizador de bromuro de paladio en el ciclo catalítico. [34]
Se están investigando diversos catalizadores de tiourea quirales para reacciones de MBH asimétricas. Los catalizadores de tiourea quirales y bis(tiourea) pueden ser eficaces en reacciones de MBH y aza-MBH catalizadas por DABCO. [35] [36] El catalizador de tiourea de Jacobsen realiza una reacción aza-MBH enantioselectiva, por ejemplo (rendimiento del 25-49 %, ee del 87-99 %).
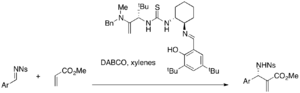
Si bien la tiourea simple requiere un catalizador nucleofílico en conjunto, los catalizadores bifuncionales como las fosfina-tioureas se pueden utilizar solos para reacciones de MBH asimétricas. Por ejemplo, varios acrilatos y aldehídos aromáticos reaccionan en presencia de estos catalizadores para producir aductos de MBH enantioméricos (rendimiento del 32-96 %, ee del 9-77 %). [37]

La reacción de MBH puede involucrar un derivado de prolina como cocatalizador. Se propuso que el catalizador nucleofílico de imidazol y la prolina efectúan la reacción a través del intermediario iminio. [38] Con (S)-prolina y DABCO, las α-amido sulfonas y los aldehídos α,β-insaturados experimentan una reacción aza-MBH altamente enantioselectiva (rendimiento del 46-87 %, E/Z 10:1-19:1, 82-99 % ee). [39]

Los aductos de Baylis-Hillman y sus derivados se han utilizado ampliamente para la generación de heterociclos y otros marcos cíclicos. [40]
Las reacciones de MBH se utilizan ampliamente en la síntesis orgánica. Por ejemplo, esta reacción se utilizó para construir intermediarios cíclicos clave para las síntesis de salinosporamida A, diversonol y anatoxina-a. [41] [42] [43]



Se han escrito muchas reseñas, entre ellas: