La atresia esofágica es una condición médica congénita ( defecto de nacimiento ) que afecta el tracto alimentario . Hace que el esófago termine en una bolsa con extremo ciego en lugar de conectarse normalmente con el estómago . Comprende una variedad de defectos anatómicos congénitos que son causados por un desarrollo embriológico anormal del esófago. Se caracteriza anatómicamente por una obstrucción congénita del esófago con interrupción de la continuidad de la pared esofágica. [2]
Las causas genéticas de EA/TEF incluyen anomalías cromosómicas o variantes en genes implicados en procesos críticos de desarrollo que son sensibles a la dosis. Se han descubierto varios genes de riesgo de EA/TEF que incluyen los reguladores transcripcionales SOX2 , MYCN, CHD7, FANCB y miembros de la familia de factores de transcripción FOX. [3]
Otros genes candidatos plausibles en la etiología de EA/TEF se identificaron como APC2, AMER3, PCDH1 , GTF3C1 , POLR2B , RAB3GAP2 e ITSN1 . [4]

Este defecto congénito surge en la cuarta semana fetal, cuando la tráquea y el esófago deberían comenzar a separarse entre sí. [5]
Puede estar asociado con trastornos del tabique traqueoesofágico . [6]
Cualquier intento de alimentarlo podría provocar neumonía por aspiración, ya que la leche se acumula en la bolsa ciega y se desborda hacia la tráquea y los pulmones. Además, una fístula entre la parte inferior del esófago y la tráquea puede permitir que el ácido del estómago fluya hacia los pulmones y cause daño. Debido a estos peligros, la afección debe tratarse lo antes posible después del nacimiento, lo que resulta en una cirugía neonatal de emergencia. [7] [8]
Pueden coexistir otros defectos congénitos, particularmente en el corazón , pero a veces también en el ano, la columna vertebral o los riñones. Esto se conoce como asociación VACTERL debido a la participación de la columna vertebral, anorrectal, cardíaca, traqueal, esofágica, renal y extremidades. Se asocia con polihidramnios en el tercer trimestre. [9]
Esta condición puede ser visible, después de aproximadamente 26 semanas, en una ecografía . En la ecografía prenatal, el hallazgo de un estómago pequeño o ausente en el contexto de polihidramnios se consideró un síntoma potencial de atresia esofágica. Sin embargo, estos hallazgos tienen un valor predictivo positivo bajo. El signo de la bolsa superior del cuello es otro signo que ayuda en el diagnóstico prenatal de la atresia esofágica y puede detectarse poco después del nacimiento, ya que el bebé afectado no podrá tragar su propia saliva . [10]
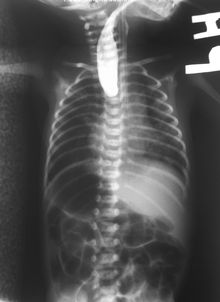
En una radiografía simple, no se verá que una sonda de alimentación pase a través del esófago y permanezca enrollada en la bolsa esofágica superior. [11]
Esta afección adopta varias formas diferentes y, a menudo, implica una o más fístulas que conectan la tráquea con el esófago ( fístula traqueoesofágica ).


Los tratamientos para la afección varían según su gravedad. El tratamiento más inmediato y eficaz en la mayoría de los casos es una reparación quirúrgica para cerrar la/s fístula/s y reconectar los dos extremos del esófago entre sí. Aunque esto generalmente se hace a través de una incisión entre las costillas del lado derecho del bebé, en algunos centros se utiliza una técnica que utiliza tres pequeñas incisiones (toracoscopia). [15]
En una minoría de casos, la brecha entre los segmentos esofágicos superior e inferior puede ser demasiado larga para salvarla. En estas situaciones, los abordajes quirúrgicos tradicionales incluyen gastrostomía seguida de extracción gástrica, transposición colónica y transposición yeyuna. [16] La dominada gástrica ha sido el enfoque preferido en muchos centros especializados, incluidos Great Ormond Street (Londres) y Mott Children's Hospital (Ann Arbor). [17] La gastrostomía, o sonda G, permite la alimentación por sonda hasta el estómago a través de la pared abdominal. A menudo, también se realiza una esofagostomía cervical para permitir que la saliva que se traga drene por un orificio en el cuello. Meses o años después, se puede reparar el esófago, a veces utilizando un segmento de intestino que se lleva hasta el tórax, interponiéndose entre los segmentos superior e inferior del esófago. [18]
Sin embargo, en algunos de estos casos llamados de separación larga, se puede utilizar un tratamiento quirúrgico avanzado desarrollado por el Dr. John Foker [19] para alargar y luego unir los segmentos esofágicos cortos. Usando la técnica de Foker, los cirujanos colocan suturas de tracción en los diminutos extremos del esófago y aumentan la tensión en estas suturas diariamente hasta que los extremos estén lo suficientemente cerca como para coserlos juntos. El resultado es un esófago que funciona normalmente, prácticamente indistinguible de uno congénitamente bien formado. Desafortunadamente, los resultados han sido algo difíciles de replicar por otros cirujanos y la necesidad de múltiples operaciones ha moderado el entusiasmo por este enfoque. El tratamiento óptimo en casos de atresia esofágica de brecha larga sigue siendo controvertido. [20]
El método de compresión magnética es otro método para reparar la atresia esofágica de gran espacio. Este método no requiere reemplazar la sección faltante con injertos de intestino u otras partes del cuerpo. El uso de fuerza electromagnética para atraer los extremos superior e inferior del esófago se intentó por primera vez en la década de 1970 utilizando bolitas de acero atraídas entre sí mediante la aplicación de electroimanes externos al paciente. En la década de 2000, el grupo de Mario Zaritzky y otros desarrollaron un mayor perfeccionamiento . [21] El método más nuevo utiliza imanes permanentes y un globo.
En abril de 2015, Annalise Dapo se convirtió en la primera paciente en los Estados Unidos a quien se le corrigió la atresia esofágica mediante imanes. [22] [26]
Las complicaciones posoperatorias pueden incluir una fuga en el sitio de cierre del esófago. A veces se desarrolla una estenosis o un punto de opresión en el esófago, lo que dificulta la deglución. La estenosis esofágica generalmente se puede dilatar con instrumentos médicos. Más adelante en la vida, la mayoría de los niños con este trastorno tendrán problemas para tragar, acidez estomacal o ambas cosas. La desmotilidad esofágica ocurre en 75-100% de los pacientes. Después de la reparación esofágica ( anastomosis ), la flacidez relativa de la antigua bolsa proximal (bolsa ciega, arriba) junto con la dismotilidad esofágica pueden causar acumulación de líquido durante la alimentación. Debido a la proximidad, el abombamiento de la bolsa puede causar oclusión traqueal. Sigue una hipoxia grave ("episodios de muerte") y, a menudo, puede ser necesaria una intervención médica. [ cita necesaria ]
La traqueomalacia, un reblandecimiento de la tráquea, generalmente por encima de la carina ( carina de la tráquea ), pero a veces también extensa en el árbol bronquial inferior, es otra posible complicación grave. Se encuentran disponibles una variedad de tratamientos para la traqueomalacia asociada con atresia esofágica. Si no es grave, la afección se puede controlar con expectación, ya que la tráquea generalmente se endurece a medida que el bebé madura hasta el primer año de vida. Cuando sólo está comprometida la tráquea por encima de la carina, una de las intervenciones "más simples" es la aortopexia, en la que el asa aórtica se une a la parte posterior del esternón, aliviando así mecánicamente la presión de la tráquea ablandada. Una intervención aún más sencilla es la colocación de un stent. Sin embargo, la proliferación de células epiteliales y la posible incorporación del stent a la tráquea pueden hacer que su extracción posterior sea peligrosa. [ cita necesaria ]
La incidencia de asma, bronquitis, hiperreactividad bronquial e infecciones recurrentes en adolescentes y adultos supervivientes de atresia esofágica supera con creces la de sus pares sanos. [27] Durante la primera década de reparación quirúrgica de la EA, hasta el 20% de los pacientes murieron de neumonía . A partir de ahí, la neumonía se ha mantenido como una complicación pulmonar importante y un motivo de reingreso después de la reparación de la AE. [27] [28] Los factores de riesgo de neumonía dentro de los primeros cinco años de vida incluyen otras infecciones respiratorias agudas y un alto número de dilataciones esofágicas. [29]
Ocurre en aproximadamente 1 de cada 3.000 nacidos vivos . [1]
La atresia esofágica (EA) congénita representa una falla del esófago para desarrollarse como un pasaje continuo. En cambio, termina como una bolsa ciega. La fístula traqueoesofágica (FTE) representa una abertura anormal entre la tráquea y el esófago. EA y TEF pueden ocurrir por separado o juntos. EA y TEF se diagnostican en la UCI al nacer y se tratan de inmediato. [ cita necesaria ]
La presencia de EA se sospecha en un lactante con salivación excesiva (babeo) y en un recién nacido con babeo que frecuentemente se acompaña de asfixia, tos y estornudos. Cuando se alimentan, estos bebés tragan normalmente pero comienzan a toser y a luchar cuando el líquido regresa por la nariz y la boca. El bebé puede volverse cianótico (se vuelve azulado debido a la falta de oxígeno) y puede dejar de respirar a medida que la tráquea aspira (succiona) el exceso de líquido de la bolsa ciega. La cianosis es el resultado del laringoespasmo (un mecanismo de protección que tiene el cuerpo para evitar la aspiración hacia la tráquea). Con el tiempo se desarrollará dificultad respiratoria. [ cita necesaria ]
Si se nota alguno de los signos/síntomas anteriores, se pasa suavemente un catéter por el esófago para comprobar si hay resistencia. Si se nota resistencia, se realizarán otros estudios para confirmar el diagnóstico. Se puede insertar un catéter que aparecerá blanco en una película de rayos X normal para demostrar el extremo de la bolsa ciega. A veces se coloca una pequeña cantidad de bario (líquido parecido a la tiza) por la boca para diagnosticar los problemas. [ cita necesaria ] Sin embargo, no se recomienda realizar un estudio de contraste oral de este tipo debido al riesgo de aspiración. [30]
El tratamiento de EA y TEF es la cirugía para reparar el defecto. Si se sospecha EA o TEF, se suspenden todas las alimentaciones orales y se inician líquidos intravenosos. Se colocará al bebé en una posición que ayude a drenar las secreciones y disminuya la probabilidad de aspiración. Los bebés con EA a veces pueden tener otros problemas. Se realizarán estudios para observar el corazón, la columna y los riñones. La cirugía para reparar la EA es esencial ya que el bebé no podrá alimentarse y es muy probable que desarrolle neumonía. Una vez que el bebé está en condiciones para la cirugía, se hace una incisión en el costado del pecho. Por lo general, el esófago se puede coser. Después de la cirugía, el bebé puede ser hospitalizado por un período de tiempo variable. El cuidado de cada bebé es individualizado. Se ve muy comúnmente en un recién nacido con ano imperforado . [ cita necesaria ]