La β-butirolactona es el éster de ácido carboxílico intramolecular ( lactona ) del ácido 3-hidroxibutanoico ópticamente activo . Se produce durante la síntesis química como racemato . La β-butirolactona es adecuada como monómero para la producción del polihidroxialcanoato biodegradable poli(3-hidroxibutirato) (PHB). La polimerización de ( RS )-β-butirolactona racémica proporciona ácido ( RS )-polihidroxibutírico, que, sin embargo, es inferior en propiedades esenciales (por ejemplo, resistencia o comportamiento de degradación) al ( R )-poli-3-hidroxibutirato procedente de fuentes naturales. [3]
La β-butirolactona se obtiene con un rendimiento del 63% mediante la adición de etanal a etenona (cetena) en presencia del mineral arcilloso montmorillonita . [4]

Para ello, también se puede producir etenona in situ mediante deshidrobromación de bromuro de acetilo con la base de Hünig diisopropiletilamina . En presencia de un complejo de aluminio quiral, la etenona reacciona enantioselectivamente con ( S )-β-butirolactona con un rendimiento del 92% con un exceso enantiomérico ee superior al 98%. [5]

La hidrogenación de dicetena en un catalizador de contacto de paladio proporciona β-butirolactona con un rendimiento del 93%. [6]

También se describe la hidrogenación asimétrica de dicetena con un catalizador BINAP de rutenio para obtener ( R )-β-butirolactona ópticamente activa con una selectividad del 97% y un exceso enantiomérico del 92%. [7]
A 50 °C y aprox. A una presión de CO de 60 bar, el (R)-2-metiloxirano ( óxido de propileno ) se carbonila a (R)-β-butirolactona manteniendo la configuración con un rendimiento del 95 %, [8] si se utiliza un catalizador de carbonilación homogéneo [(salph)Al( Se utiliza THF) 2 ][Co(CO) 4 ] según Geoffrey Coates [9] (accesible a partir de un complejo de aluminio-saleno modificado [(salph)AlCl y cobaltato de tetracarbonilo de sodio NaCo(CO) 4 ]).

La carbonilación de 2-metiloxirano en presencia de catalizadores homogéneos de porfirina-carbonilcobaltato en tetrahidrofurano también tiene éxito con aprox. Una presión parcial de monóxido de carbono de 14 bar produce β-butirolactona con un rendimiento del 97 %. [10]
Debido a los problemas que surgen con la separación y el reciclaje de catalizadores de carbonilación homogéneos, recientemente también se han investigado análogos de polímeros heterogéneos, que ofrecen rendimientos igualmente altos (hasta 96%) a 60 bar de presión de CO. Sin embargo, estos catalizadores todavía no parecen ser candidatos prometedores para aplicaciones industriales, ya que muestran una actividad catalítica drásticamente menor en lotes de laboratorio de 50 mm molares. [11]
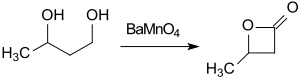
El barato material de partida butano-1,3-diol se puede convertir con el agente oxidante manganato de bario (BaMnO 4 ) en acetonitrilo bajo irradiación con microondas en 1 hora a β-butirolactona (rendimiento del 74%). [12]
La β-butirolactona es un líquido transparente que huele a acetona o menta. [1] Es miscible con agua y soluble en muchos disolventes orgánicos. Según la clasificación de la IARC , la β-butirolactona pertenece al grupo 2B: "posiblemente cancerígeno".
( R )-β-butirolactona reacciona en tolueno a aprox. 14 bar de presión de CO y 55 ° C en presencia de un complejo salen dentro de 24 h con inversión de la configuración con un rendimiento del 94% para anhídrido ópticamente puro (> 99% ee) ( S ) -metilsuccínico. [13]

La comercialización del ácido polihidroxibutírico (PHB) o de los polihidroxialcanoatos homo y copoliméricos como termoplásticos aeróbicamente biodegradables aislados de bacterias bajo la marca Biopol de Imperial Chemical Industries (ICI) en 1983 marcó el punto de partida para la búsqueda de alternativas sintéticas que Evite las desventajas del PHB, como la fragilidad y la rigidez, la descomposición térmica a temperaturas justo por encima de la temperatura de fusión (175 - 180 °C) y, en particular, costes no competitivos [14] debido a la costosa fermentación, aislamiento y purificación.
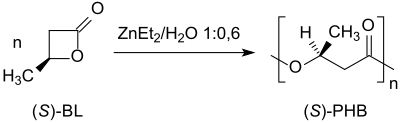
La polimerización con apertura de anillo de ( S )-β-butirolactona con dietilzinc ZnEt 2 /agua produce poli-( S )-3-hidroxibutirato con ee > 97% bajo retención de la configuración en el átomo de carbono quiral: [15]
Con compuestos de estaño (distannoxanos) como catalizadores, la polimerización de ( R )-β-butirolactona produce también polihidroxibutiratos (R) sintéticos de alto peso molecular (Mn > 100.000) con retención, que se parecen a los polihidroxialcanoatos naturales. [dieciséis]
La polimerización aniónica de β-butirolactona ópticamente activa conduce a polihidroxibutiratos isotácticos cristalinos mediante inversión, cuya baja polidispersidad Mw / Mn ≈ 1,2 indica una polimerización viva . [17] [18]

También las bases fuertes como el diazabicicloundeceno (DBU), el 1,5,7-triazabiciclo(4.4.0)dec-5-en (TBD) y el fosfaceno BEMP pueden catalizar la polimerización con apertura de anillo de la β-butirolactona en sustancia a 60 °C logrando PHB de bajo peso molecular (M n < 21.000) con distribución estrecha de peso molecular. [19]
La polimerización catiónica con apertura de anillo de β-butirolactona con ácidos fuertes como el ácido trifluorometanosulfónico conduce a PHB de bajo peso molecular (M n < 8200) con extremos de cadena hidroxilo vivos en los que se pueden copolimerizar, por ejemplo, bloques de caprolactona . [20]

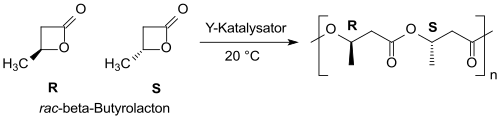
Con catalizadores a base de itrio , la β-butirolactona racémica se puede convertir en PHB (principalmente) sindiotáctico con una distribución de peso molecular estrecha. [21] [22]
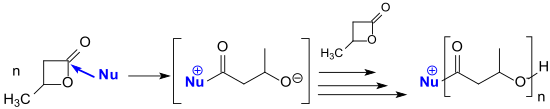
Los carbenos N-heterocíclicos (NHC) del tipo imidazol-2-ilideno son fuertes nucleófilos y también son adecuados como iniciadores para la polimerización con apertura de anillo de lactonas como la β-butirolactona. [23]
Las variantes sintéticas del PHB, que se desarrollaron como homopolímeros de β-butirolactona o copolímeros con otras lactonas, hasta ahora no han podido compensar las debilidades del material biogénico, en particular las propiedades mecánicas y térmicas desfavorables y el alto precio. En cambio, se han introducido nuevos problemas con metales pesados tóxicos en los catalizadores (p. ej. estaño, cobalto o cromo) y componentes poliméricos atácticos (líquidos y difíciles de separar) con propiedades materiales indeseables. Incluso más de 30 años después de su lanzamiento al mercado, el éxito económico del biopolímero Biopol® y sus análogos (bio)sintéticos sigue siendo modesto, y a pesar de los ambiciosos objetivos de capacidad (capacidad real de producción mundial de polihidroxialcanoato en 2018: aproximadamente 30 000 toneladas [24] ). Las ventas hasta ahora están muy por detrás de las optimistas previsiones de los fabricantes.