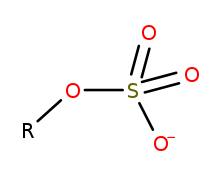
En la química de los organosulfurados , los organosulfatos son una clase de compuestos orgánicos que comparten un grupo funcional común con la estructura R−O−SO−3. El núcleo SO 4 es un grupo sulfato y el grupo R es cualquier residuo orgánico . Todos los organosulfatos son formalmente ésteres derivados de alcoholes y ácido sulfúrico ( H 2 SO 4 ), aunque muchos no se preparan de esta manera. Muchos ésteres de sulfato se utilizan en detergentes y algunos son reactivos útiles . Los alquilsulfatos constan de una cadena de hidrocarburo hidrófoba , un grupo sulfato polar (que contiene un anión) y un catión o amina para neutralizar el grupo sulfato. Los ejemplos incluyen: lauril sulfato de sodio (también conocido como sal sódica del éster mono dodecílico del ácido sulfúrico) y sales de potasio y amonio relacionadas.
Los sulfatos de alquilo se utilizan comúnmente como surfactantes aniónicos en jabones líquidos y detergentes utilizados para limpiar lana, como limpiadores de superficies y como ingredientes activos en detergentes para ropa, champús y acondicionadores. También se pueden encontrar en productos para el hogar como pasta de dientes, antiácidos, cosméticos y alimentos. Generalmente se encuentran en productos de consumo en concentraciones que van del 3 al 20%. En 2003 se utilizaron aproximadamente 118.000 t/a de sulfatos de alquilo en los EE. UU. [1]
Un ejemplo común es el lauril sulfato de sodio , con la fórmula CH 3 (CH 2 ) 11 OSO 3 Na. También son comunes en productos de consumo los ésteres de sulfato de alcoholes grasos etoxilados , como los derivados del alcohol laurílico . Un ejemplo es el lauril éter sulfato de sodio , un ingrediente de algunos cosméticos . [2]
El alquilsulfato se puede producir a partir de alcoholes, que a su vez se obtienen por hidrogenación de aceites y grasas animales o vegetales o mediante el proceso Ziegler o mediante síntesis oxo . Si se produce a partir de materias primas oleoquímicas o mediante el proceso Ziegler, la cadena de hidrocarburos del alcohol será lineal. Si se obtiene mediante el proceso oxo, aparecerá un bajo nivel de ramificación, generalmente con un grupo metilo o etilo en la posición C-2, que contiene cantidades pares e impares de cadenas alquílicas. [3] Estos alcoholes reaccionan con el ácido clorosulfúrico :
Alternativamente, los alcoholes se pueden convertir en ésteres de semisulfato utilizando trióxido de azufre : [4]
Los organosulfatos especializados se pueden preparar mediante la oxidación de fenoles con persulfato de Elbs y la oxidación de anilinas con Boyland-Sims .

Una familia menos común de organosulfatos tiene la fórmula RO-SO 2 -OR'. Se preparan a partir de ácido sulfúrico y alcohol. Los principales ejemplos son el sulfato de dietilo y el sulfato de dimetilo , líquidos incoloros que se utilizan como reactivos en la síntesis orgánica . Estos compuestos son agentes alquilantes potencialmente peligrosos . Los dialquilsulfatos no se encuentran en la naturaleza. [5]

Existen varias clases de ésteres de sulfato en la naturaleza. Especialmente comunes son los derivados de azúcar como el sulfato de queratán , el sulfato de condroitina y el anticoagulante heparina . [6] Las modificaciones postraduccionales de algunas proteínas implican sulfatación, a menudo en el grupo fenol de los residuos de tirosina . [7] Un sulfato esteroide es el sulfato de estradiol , un precursor latente de la hormona estrógeno.
Una parte importante del azufre del suelo se encuentra en forma de ésteres de sulfato. [8]
El sulfato es un anión inerte, por lo que la naturaleza lo activa mediante la formación de derivados éster de adenosina 5'-fosfosulfato (APS) y 3'-fosfoadenosina-5'-fosfosulfato (PAPS). Muchos organismos utilizan estas reacciones con fines metabólicos o para la biosíntesis de compuestos de azufre necesarios para la vida. [9] La formación e hidrólisis de ésteres de sulfato naturales son catalizadas por sulfatasas (también conocidas como sulfohidrolasas). [5]
Debido a que se utilizan ampliamente en productos comerciales, los aspectos de seguridad de los organosulfatos se investigan en profundidad. [10]
Los alquilsulfatos, si se ingieren, se absorben bien y se metabolizan en un sulfato C3, C4 o C5 y un metabolito adicional. El mayor irritante de los alquilsulfatos es el laurilsulfato de sodio, con un umbral antes de la irritación a una concentración del 20%. Los surfactantes en productos de consumo suelen estar mezclados, lo que reduce la probabilidad de irritación. Según la TG 406 de la OCDE , no se encontró que los alquilsulfatos en estudios con animales fueran sensibilizadores de la piel. [10] [11]
Los estudios de laboratorio no han demostrado que los sulfatos de alquilo sean genotóxicos , mutagénicos o cancerígenos . No se han encontrado efectos reproductivos a largo plazo. [12]
El principal destino del sulfato de alquilo de los productos comerciales usados son las aguas residuales. Se ha medido que la concentración de sulfatos de alquilo en los efluentes de las plantas de tratamiento de aguas residuales (PTAR) es de 10 microgramos por litro (5,8 × 10 −9 oz/pulgada cúbica) y menor. Los sulfatos de alquilo se biodegradan fácilmente, probablemente incluso antes de llegar a la PTAR. Una vez en la planta de tratamiento, se eliminan rápidamente por biodegradación . Se descubrió que los invertebrados son el grupo trófico más sensible a los sulfatos de alquilo. Se descubrió que el laurilsulfato de sodio probado en Uronema parduczi , un protozoo, tenía el valor de efecto más bajo, con una EC5 a las 20 h de 0,75 miligramos por litro (2,7 × 10 −8 lb/pulgada cúbica). Las pruebas de exposición crónica con C 12 a C 18 con el invertebrado Ceriodaphnia dubia encontraron que la toxicidad más alta es con C 14 ( NOEC fue de 0,045 mg/L).
En términos de estabilidad térmica, los sulfatos de alquilo se degradan mucho antes de alcanzar su punto de ebullición debido a la baja presión de vapor (para C 8-18 de 10-11 a 10-15 hPa). La sorción del suelo es proporcional a la longitud de la cadena de carbono, y una longitud de 14 o más tiene la tasa de sorción más alta. Se ha encontrado que las concentraciones en el suelo varían de 0,0035 a 0,21 miligramos por kilogramo (5,6 × 10 −8 a 3,4 × 10 −6 oz/lb) de peso seco.