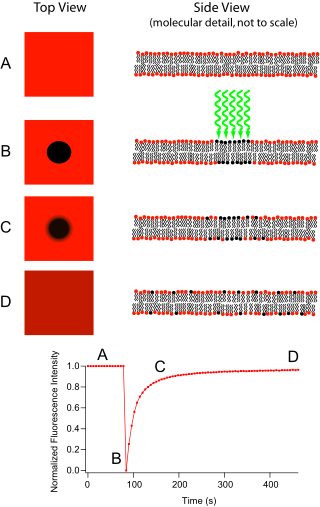
La recuperación de fluorescencia después del fotoblanqueo (FRAP) es un método para determinar la cinética de difusión a través de tejidos o células. Es capaz de cuantificar la difusión lateral bidimensional de una película molecularmente delgada que contiene sondas marcadas con fluorescencia, o de examinar células individuales. Esta técnica es muy útil en estudios biológicos de difusión de membranas celulares y unión de proteínas. Además, la deposición superficial de una bicapa (o monocapa) de fosfolípidos fluorescente permite la caracterización de superficies hidrófilas (o hidrófobas ) en términos de estructura superficial y energía libre.
Se han desarrollado técnicas similares, aunque menos conocidas, para investigar la difusión tridimensional y la unión de moléculas dentro de la célula; También se les conoce como FRAP.
El aparato básico comprende un microscopio óptico , una fuente de luz y una sonda fluorescente . La emisión fluorescente depende de la absorción de una longitud de onda óptica específica o de un color que restringe la elección de lámparas. Lo más común es que se utilice una fuente de mercurio o xenón de amplio espectro junto con un filtro de color. La técnica comienza guardando una imagen de fondo de la muestra antes del fotoblanqueo. A continuación, la fuente de luz se enfoca en una pequeña porción del área visible, ya sea cambiando a un objetivo de microscopio de mayor aumento o con luz láser de la longitud de onda adecuada. Los fluoróforos en esta región reciben una iluminación de alta intensidad que hace que su vida de fluorescencia transcurra rápidamente (limitada a aproximadamente 10 5 fotones antes de la extinción). Ahora la imagen en el microscopio es la de un campo uniformemente fluorescente con una mancha oscura notable. A medida que avanza el movimiento browniano, las sondas aún fluorescentes se difundirán por toda la muestra y reemplazarán a las sondas no fluorescentes en la región blanqueada. Esta difusión se produce de forma ordenada, determinable analíticamente a partir de la ecuación de difusión . Suponiendo un perfil gaussiano para el haz de blanqueo, la constante de difusión D puede calcularse simplemente a partir de:
donde w es el radio del haz y t D es el tiempo de difusión "característico". [1] [2]
Originalmente, la técnica FRAP estaba destinada a ser utilizada como un medio para caracterizar la movilidad de moléculas lipídicas individuales dentro de una membrana celular. [1] Si bien proporciona una gran utilidad en esta función, la investigación actual se inclina más hacia la investigación de membranas lipídicas artificiales. Soportadas por sustratos hidrofílicos o hidrofóbicos (para producir bicapas o monocapas lipídicas respectivamente) e incorporando proteínas de membrana , estas estructuras biomiméticas son potencialmente útiles como dispositivos analíticos para determinar la identidad de sustancias desconocidas, comprender la transducción celular e identificar sitios de unión de ligandos.
Esta técnica se usa comúnmente junto con proteínas de fusión de proteína fluorescente verde (GFP) , donde la proteína estudiada se fusiona con una GFP. Cuando es excitada por una longitud de onda de luz específica, la proteína emitirá fluorescencia. [3] Cuando la proteína que se está estudiando se produce con GFP, entonces se puede rastrear la fluorescencia. Fotodestruir la GFP y luego observar la repoblación en el área blanqueada puede revelar información sobre los socios de interacción de proteínas, la continuidad de los orgánulos y el tráfico de proteínas. [4]
Si después de un tiempo la fluorescencia ya no alcanza el nivel inicial, entonces una parte de la fluorescencia es causada por una fracción inmóvil (que no puede reponerse mediante difusión). De manera similar, si las proteínas fluorescentes se unen a receptores celulares estáticos, la tasa de recuperación se verá retardada por un factor relacionado con los coeficientes de asociación y disociación de la unión. Esta observación se ha aprovechado más recientemente para investigar la unión a proteínas. [3] [5] [6] De manera similar, si la proteína marcada con GFP se incorpora constitutivamente a un complejo más grande, la dinámica de recuperación de la fluorescencia se caracterizará por la difusión del complejo más grande. [7]
FRAP también se puede utilizar para controlar proteínas fuera de la membrana. Después de que la proteína de interés se vuelve fluorescente, generalmente mediante expresión como una proteína de fusión GFP, se utiliza un microscopio confocal para fotoblanquear y monitorear una región del citoplasma , [3] huso mitótico , núcleo u otra estructura celular. [8] [9] La fluorescencia media en la región luego se puede representar gráficamente versus el tiempo desde el fotoblanqueo, y la curva resultante puede producir coeficientes cinéticos, como aquellos para las reacciones de unión de la proteína y/o el coeficiente de difusión de la proteína en el medio donde está siendo monitoreado. [10] A menudo, las únicas dinámicas consideradas son la difusión y las interacciones de unión/desunión; sin embargo, en principio las proteínas también pueden moverse a través del flujo, es decir, sufrir un movimiento dirigido, y esto fue reconocido muy temprano por Axelrod et al. [1] Esto podría deberse al flujo del citoplasma o nucleoplasma, o al transporte a lo largo de filamentos de la célula, como los microtúbulos, mediante motores moleculares .
El análisis es más sencillo cuando la recuperación de la fluorescencia está limitada por la velocidad de difusión en el área blanqueada o por la velocidad a la que las proteínas blanqueadas se liberan de sus sitios de unión dentro del área blanqueada y son reemplazadas por proteínas fluorescentes. Veamos estos dos límites, para el caso común de blanquear una proteína de fusión GFP en una célula viva.
Para una mancha de blanqueo circular de radio y recuperación dominada por la difusión, la fluorescencia se describe mediante una ecuación derivada de Soumpasis [11] (que involucra funciones de Bessel modificadas y )
con el cronograma característico de la difusión, y es el tiempo. es la fluorescencia normalizada (va a 1 cuando llega al infinito). La escala de tiempo de difusión para una mancha blanqueada de radio es , siendo D el coeficiente de difusión.
Tenga en cuenta que esto es para un blanqueo instantáneo con un perfil de función escalonada, es decir, la fracción de proteína que se supone que se blanquea instantáneamente en el momento es , y , for es la distancia desde el centro del área blanqueada. También se supone que la recuperación se puede modelar mediante difusión en dos dimensiones, que también es uniforme e isotrópica. En otras palabras, esa difusión ocurre en un medio uniforme, por lo que la constante de difusión efectiva D es la misma en todas partes, y la difusión es isotrópica, es decir, ocurre a la misma velocidad a lo largo de todos los ejes del plano.
En la práctica, en una celda ninguna de estas suposiciones será estrictamente cierta.
Por lo tanto, la ecuación de Soumpasis es solo una aproximación útil, que puede usarse cuando los supuestos enumerados anteriormente son buenas aproximaciones a la situación real y cuando la recuperación de la fluorescencia está realmente limitada por la escala de tiempo de difusión . Tenga en cuenta que el hecho de que Soumpasis pueda ajustarse adecuadamente a los datos no implica necesariamente que los supuestos sean ciertos y que la difusión domine la recuperación.
La ecuación que describe la fluorescencia en función del tiempo es particularmente sencilla en otro límite. Si una gran cantidad de proteínas se unen a sitios en un volumen pequeño, de modo que allí la señal de fluorescencia esté dominada por la señal de las proteínas unidas, y si esta unión está toda en un solo estado con una tasa de desactivación k off , entonces la fluorescencia como la función del tiempo viene dada por [15]
Tenga en cuenta que la recuperación depende únicamente de la constante de velocidad para la desvinculación, koff . No depende de la tasa de encuadernación. Aunque depende de una serie de supuestos [15]
Si se cumplen todos estos supuestos, entonces ajustar una exponencial a la curva de recuperación dará como resultado una tasa de desconexión constante , koff . Sin embargo, otras dinámicas pueden dar curvas de recuperación similares a las exponenciales, por lo que ajustar una exponencial no implica necesariamente que la recuperación esté dominada por una reacción bimolecular simple. Una forma de distinguir entre la recuperación con una tasa determinada por la desvinculación y la recuperación limitada por la difusión es observar que la tasa de recuperación para la recuperación limitada por la desvinculación es independiente del tamaño del área blanqueada r , mientras que escala como , para la difusión. -recuperación limitada. Por lo tanto, si se blanquean un área pequeña y una grande, si la recuperación está limitada por la separación, entonces las tasas de recuperación serán las mismas para los dos tamaños de área blanqueada, mientras que si la recuperación está limitada por la difusión, entonces será mucho más lenta para el área blanqueada más grande. área.
En general, la recuperación de la fluorescencia no estará dominada ni por la difusión isotrópica simple ni por una única tasa de desvinculación simple. Habrá tanto difusión como unión y, de hecho, la constante de difusión puede no ser uniforme en el espacio y puede haber más de un tipo de sitios de unión, y estos sitios también pueden tener una distribución no uniforme en el espacio. Los procesos de flujo también pueden ser importantes. Este comportamiento más complejo implica que se requiere un modelo con varios parámetros para describir los datos; Los modelos con una sola constante de difusión D o una única constante de velocidad de salida, koff , son inadecuados .
Hay modelos tanto con difusión como con reacción. [2] Desafortunadamente, una sola curva FRAP puede proporcionar evidencia insuficiente para ajustar de manera confiable y única datos experimentales (posiblemente ruidosos). Sadegh Zadeh et al. [16] han demostrado que las curvas FRAP pueden ajustarse mediante diferentes pares de valores de la constante de difusión y la constante de velocidad de transmisión o, en otras palabras, que los ajustes al FRAP no son únicos. Esto se realiza en ajustes de tres parámetros (constante de velocidad activa, constante de velocidad desactivada y constante de difusión). Los ajustes que no son únicos generalmente no son útiles.
Por lo tanto, para modelos con varios parámetros, un solo experimento FRAP puede ser insuficiente para estimar todos los parámetros del modelo. Entonces se requieren más datos, por ejemplo, blanqueando áreas de diferentes tamaños, [14] determinando algunos parámetros del modelo de forma independiente, etc.