
La catálisis supramolecular se refiere a una aplicación de la química supramolecular , especialmente el reconocimiento molecular y la unión de huéspedes, hacia la catálisis. [1] [2] Este campo se inspiró originalmente en el sistema enzimático que, a diferencia de las reacciones de la química orgánica clásica, utiliza interacciones no covalentes como enlaces de hidrógeno, interacción catión-pi y fuerzas hidrofóbicas para acelerar drásticamente la velocidad de reacción y/o permitir que ocurran reacciones altamente selectivas. Debido a que las enzimas son estructuralmente complejas y difíciles de modificar, los catalizadores supramoleculares ofrecen un modelo más simple para estudiar los factores involucrados en la eficiencia catalítica de la enzima. [1] : 1 Otro objetivo que motiva este campo es el desarrollo de catalizadores eficientes y prácticos que pueden o no tener un equivalente enzimático en la naturaleza.
Un campo de estudio relacionado es la catálisis asimétrica , que requiere el reconocimiento molecular para diferenciar los materiales de partida enantioméricos. Podría categorizarse como un área de la catálisis supramolecular, pero la catálisis supramolecular no implica necesariamente reacciones asimétricas.


El término química supramolecular fue definido por Jean-Marie Lehn como "la química del enlace intermolecular, que abarca las estructuras y funciones de las entidades formadas por la asociación de dos o más especies químicas" en su discurso del Nobel en 1987, [5] pero el concepto de catálisis supramolecular fue iniciado mucho antes en 1946 por Linus Pauling cuando fundó la teoría de la catálisis enzimática en la que la aceleración de la velocidad es el resultado de la estabilización no covalente del estado de transición por las enzimas. [6] Sin embargo, no fue hasta unas décadas más tarde que se desarrolló una enzima artificial. Los primeros imitadores de enzimas simples se basaron en éter corona y criptando. [7] En 1976, menos de diez años después del descubrimiento del éter corona, Cram et al. desarrollaron un éter corona binaftílico funcionalizado que cataliza la transacilación. [3] El catalizador aprovecha la capacidad del motivo éter corona para capturar el catión para unirse a la parte de iones amonio del sustrato y posteriormente emplea el motivo tiol cercano para escindir el éster.
Desde principios de la década de 1970, las ciclodextrinas se han estudiado ampliamente por sus propiedades de encapsulación y se han utilizado como sitios de unión en catalizadores supramoleculares. [2] Las ciclodextrinas tienen una estructura de anillo rígido, una superficie hidrófila y una cavidad hidrófoba en el interior; por lo tanto, son capaces de unirse a moléculas orgánicas en solución acuosa. En 1978, con el conocimiento de fondo de que la hidrólisis del acetato de m-terc-butilfenilo se acelera en presencia de ácido 2-bencimidazolacético y alfa-ciclodextrina, [8] Brewslow et al. desarrollaron un catalizador basado en una beta-ciclodextrina que porta dos grupos imidazol. Este sistema catalítico de ciclodextrina imita a la ribonucleasa A mediante el uso de un imidazol neutro y un catión imidazolio para escindir selectivamente sustratos de fosfato cíclico. La velocidad de la reacción se cataliza 120 veces más rápido y, a diferencia de una hidrólisis por la simple base NaOH que da una mezcla 1:1 de los productos, este catalizador produce una selectividad de 99:1 para un compuesto. [4]
En 1993 se obtuvo la primera cápsula autoensamblada [9] y en 1997 se utilizó la denominada estructura de "pelota de tenis" para catalizar una reacción de Diels-Alder. [10] Las moléculas autoensambladas tienen una ventaja sobre el éter corona y la ciclodextrina en que pueden capturar moléculas significativamente más grandes o incluso dos moléculas al mismo tiempo. En las décadas siguientes, muchos grupos de investigación, como Makoto Fujita, Ken Raymond y Jonathan Nitschke, desarrollaron catalizadores tipo jaula también a partir del principio de autoensamblaje molecular .
En 2002, Sanders y sus colaboradores publicaron el uso de la técnica de biblioteca combinatoria dinámica para construir un receptor [11] y en 2003 emplearon la técnica para desarrollar un catalizador para la reacción de Diels-Alder. [12]
A continuación se describen algunos modos comunes de catálisis supramolecular.

Un huésped supramolecular podría unirse a una molécula huésped de tal manera que el grupo lábil del huésped se posicione cerca del grupo reactivo de otra especie reactiva. La proximidad de los dos grupos aumenta la probabilidad de que la reacción pueda ocurrir y, por lo tanto, aumenta la velocidad de reacción. Este concepto es similar al principio de preorganización que establece que la formación de complejos podría mejorarse si los motivos de unión están preorganizados en una posición bien definida de modo que el huésped no requiera ningún cambio conformacional importante para la formación de complejos. [14] En este caso, el catalizador está preorganizado de tal manera que no se requieren cambios conformacionales importantes para que ocurra la reacción. Un ejemplo notable de catalizadores que emplean este mecanismo es el éter corona de Jean-Marie Lehn. [13] Además, los catalizadores basados en ciclodextrinas funcionalizadas a menudo emplean este modo de catálisis. [15] : 88
Las reacciones bimoleculares dependen en gran medida de la concentración de sustratos. Por lo tanto, cuando un contenedor supramolecular encapsula ambos reactivos dentro de su pequeña cavidad, la concentración local efectiva de los reactivos aumenta y, como resultado de un efecto entrópico, la velocidad de la reacción se acelera. [15] : 89 Es decir, una reacción intramolecular es más rápida que su reacción intermolecular correspondiente.
Aunque se observa un gran aumento en la concentración efectiva, las moléculas que emplean este modo de catálisis tienen una aceleración de velocidad mínima en comparación con la de las enzimas. Una explicación propuesta es que en un recipiente los sustratos no están tan fuertemente unidos como en una enzima. Los reactivos tienen espacio para moverse en una cavidad y, por lo tanto, el efecto entrópico podría no ser tan importante. Incluso en el caso de las enzimas, los estudios computacionales han demostrado que el efecto entrópico también podría sobreestimarse. [16]
Ejemplos de moléculas que funcionan a través de este mecanismo son la pelota de tenis de Rebek y el complejo octaédrico de Fujita. [10] [17]

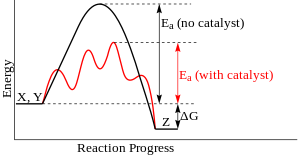
Los catalizadores supramoleculares pueden acelerar las reacciones no solo colocando los dos reactivos en estrecha proximidad, sino también estabilizando el estado de transición de la reacción y reduciendo la energía de activación . [15] : 89 Si bien este principio fundamental de catálisis es común en catalizadores heterogéneos o de moléculas pequeñas, los catalizadores supramoleculares tienen dificultades para utilizar el concepto debido a sus estructuras a menudo rígidas. A diferencia de las enzimas que pueden cambiar de forma para adaptarse a los sustratos, las supramoléculas no tienen ese tipo de flexibilidad y, por lo tanto, rara vez logran el ajuste subangstrom necesario para la estabilización perfecta del estado de transición. [1] : 2
Un ejemplo de catalizadores de este tipo es el trímero de porfirina de Sander. Una reacción de Diels Alder entre dos sustratos funcionalizados con piridina normalmente produce una mezcla de productos endo y exo. Sin embargo, en presencia de los dos catalizadores, se podría obtener una selectividad endo o exo completa. La causa subyacente de la selectividad es la interacción de coordinación entre la piridina y el ion zinc en la porfirina. Dependiendo de la forma de los catalizadores, se prefiere un producto sobre el otro. [18]

El enfoque tradicional de los catalizadores supramoleculares se centra en el diseño de receptores macromoleculares con grupos funcionales catalíticos ubicados apropiadamente. Estos catalizadores suelen inspirarse en la estructura de enzimas con el grupo catalítico imitando residuos de aminoácidos reactivos, pero a diferencia de las enzimas reales, los sitios de unión de estos catalizadores son estructuras rígidas hechas de bloques de construcción químicos. [19] Todos los ejemplos de este artículo se desarrollaron mediante el enfoque de diseño.
Jeremy Sanders señaló que el enfoque de diseño no ha tenido éxito y ha producido muy pocos catalizadores eficientes debido a la rigidez de las supramoléculas. Argumentó que las moléculas rígidas con un ligero desajuste con el estado de transición no pueden ser un catalizador eficiente. En lugar de invertir tanto esfuerzo de síntesis en una molécula rígida que no podamos determinar su geometría precisa al nivel de subangstroms que se requiere para una buena estabilización, Sanders sugirió el uso de muchos bloques de construcción flexibles pequeños con interacciones débiles en competencia para que sea posible que el catalizador ajuste su estructura para acomodarse mejor al sustrato. [20] Existe una compensación directa entre el beneficio entálpico de la estructura flexible y el beneficio entrópico de la estructura rígida. [1] : 3 La estructura flexible podría quizás unir mejor el estado de transición, pero deja más espacio para que los sustratos se muevan y vibren. La mayoría de los químicos supramoleculares en el pasado preferían construir estructuras rígidas por miedo al costo entrópico. [20]
Este problema podría ser solucionado con el "enfoque de adentro hacia afuera" de Baker y Houk , que permite un desarrollo sistemático de enzimas de novo. [21] Este método computacional comienza simplemente con una estructura de estado de transición predicha y lentamente va construyendo hacia afuera mediante la optimización de la disposición de los grupos funcionales para estabilizar el estado de transición. Luego, completa el resto del sitio activo y, finalmente, genera un andamiaje proteico completo que podría contener el sitio activo diseñado. Este método podría aplicarse potencialmente a la catálisis supramolecular, aunque una plétora de bloques de construcción químicos podría fácilmente abrumar el modelo computacional diseñado para trabajar con 20 aminoácidos.

Suponiendo que la actividad catalítica depende en gran medida de la afinidad del catalizador con el estado de transición, se podría sintetizar un análogo del estado de transición (TSA), una estructura que se asemeja al estado de transición de la reacción. Luego, se podría unir el TSA a un soporte sólido o una etiqueta identificable y usar ese TSA para seleccionar un catalizador óptimo de una mezcla de muchos catalizadores potenciales diferentes generados química o biológicamente mediante una síntesis orientada a la diversidad . Este método permite una selección rápida de una biblioteca de compuestos diversos. No requiere tanto esfuerzo sintético y permite un estudio de varios factores catalíticos simultáneamente. Por lo tanto, el método podría producir potencialmente un catalizador eficiente que no podríamos haber diseñado con nuestro conocimiento actual. [19]
Se desarrollaron y estudiaron muchos anticuerpos catalíticos utilizando este enfoque.

Un problema con el enfoque de selección de análogos de estados de transición es que la actividad catalítica no es un criterio de selección. Los TSA no necesariamente representan estados de transición reales y, por lo tanto, un catalizador obtenido a partir de la selección podría ser simplemente el mejor receptor para un TSA, pero no es necesariamente el mejor catalizador. Para evitar este problema, la actividad catalítica debe medirse directamente y también rápidamente. Para desarrollar una selección de alto rendimiento , los sustratos podrían diseñarse para cambiar de color o liberar un producto fluorescente al reaccionar. Por ejemplo, Crabtree y colaboradores utilizaron este método en la selección de catalizadores de hidrosilación para alquenos e iminas. [22] Desafortunadamente, el requisito previo para tales sustratos limita el rango de reacciones para el estudio. [19]

A diferencia de la síntesis combinatoria tradicional, en la que primero se generaba una biblioteca de catalizadores y luego se seleccionaba (como en los dos enfoques anteriores), el enfoque de biblioteca combinatoria dinámica utiliza una mezcla de bloques de construcción multicomponentes que forman reversiblemente una biblioteca de catalizadores. Sin una plantilla, la biblioteca consiste en una mezcla aproximadamente igual de diferentes combinaciones de bloques de construcción. En presencia de una plantilla que es un material de partida o un TSA, la combinación que proporciona la mejor unión a la plantilla es termodinámicamente favorable y, por lo tanto, esa combinación es más frecuente que otros miembros de la biblioteca. La relación sesgada del catalizador deseado con otros productos combinatorios podría entonces congelarse terminando la reversibilidad del equilibrio por medios tales como el cambio de temperatura, pH o radiación para producir el catalizador óptimo. [19] Por ejemplo, Lehn et al. utilizaron este método para crear una biblioteca combinatoria dinámica de inhibidor de imina a partir de un conjunto de aminas y un conjunto de aldehídos. Después de algún tiempo, el equilibrio se terminó mediante una adición de NaBH 3 CN para proporcionar el catalizador deseado. [23]
En la naturaleza, la piruvato oxidasa emplea dos cofactores, el pirofosfato de tiamina (ThDP) y el dinucleótido de flavina y adenina (FAD), para catalizar la conversión de piruvato en acetilfosfato. En primer lugar, el ThDP media la descarboxilación del piruvato y genera un aldehído activo como producto. A continuación, el aldehído se oxida mediante el FAD y posteriormente es atacado por el fosfato para producir acetilfosfato.
Este sistema biológico inspiró el diseño de un catalizador supramolecular basado en ciclofano . El catalizador tiene un ión tiazolio, una parte reactiva del ThDP y flavina, un núcleo básico del FAD, en estrecha proximidad y cerca del sitio de unión del sustrato. El ciclo catalítico es casi el mismo que en la naturaleza, excepto que el sustrato es un aldehído aromático en lugar de piruvato. Primero, el catalizador une el sustrato dentro de su anillo de ciclofano. Luego, utiliza el ión tiazolio para condensarse con el sustrato generando un aldehído activo. Este aldehído es oxidado por la flavina y luego atacado por el metanol para producir un éster metílico. [24]

Las enzimas procesivas son proteínas que catalizan reacciones consecutivas sin liberar su sustrato. Un ejemplo de enzimas procesivas es la ARN polimerasa, que se une a una cadena de ADN y cataliza repetidamente transferencias de nucleótidos, sintetizando eficazmente una cadena de ARN correspondiente.
Se ha diseñado una enzima procesiva artificial en forma de rotaxano de porfirina de manganeso que se desplaza a lo largo de un polímero largo de alqueno y cataliza múltiples rondas de epoxidación de alqueno. El ion manganeso (III) en la porfirina es el centro catalítico de la molécula, capaz de epoxidar en presencia de un donante de oxígeno y un ligando activador. Con un ligando pequeño como la piridina que se une al manganeso desde el interior de la cavidad del rotaxano, la epoxidación ocurre fuera del catalizador. Sin embargo, con un ligando grande y voluminoso como la piridina de terc-butilo que no cabe dentro de la cavidad, la epoxidación ocurre en el interior del catalizador. [25]

Un huésped supramolecular M 4 L 6 (4 iones de galio y 6 ligandos para cada complejo) se autoensambla mediante interacción metal-ligando en solución acuosa. Esta molécula contenedora es polianiónica y, por lo tanto, su cavidad en forma de tetraedro es capaz de encapsular y estabilizar una molécula catiónica. En consecuencia, la molécula encapsulada se puede protonar fácilmente ya que un carbocatión resultante de la protonación se estabiliza por los aniones circundantes. Este contenedor ayuda en las ciclizaciones de Nazarov catalizadas por ácido. El catalizador acelera la reacción más de un millón de veces, lo que lo convierte en el catalizador supramolecular más eficiente hasta la fecha. Se propuso que una actividad catalítica tan alta no surge solo de la mayor basicidad del sustrato encapsulado, sino también de la unión constrictiva que estabiliza el estado de transición de la ciclización. Desafortunadamente, este catalizador tiene un problema con la inhibición del producto . Para evitar ese problema, el producto de la reacción de ciclización podría hacerse reaccionar con un dienófilo transformándolo en un aducto de Diels-Alder que ya no cabe dentro de la cavidad del catalizador. [26]
En este caso, el huésped supramolecular fue diseñado inicialmente para capturar simplemente huéspedes catiónicos. Casi una década después, se utilizó como catalizador para la ciclización de Nazarov.

Fujita y colaboradores descubrieron un contenedor supramolecular autoensamblable M6L4 ( 6 iones de paladio y 4 ligandos en cada complejo) que podría mejorarse hasta convertirse en una supramolecula quiral mediante la adición de un auxiliar quiral periférico. En este caso, el auxiliar dietildiaminociclohexano no activa directamente el sitio catalítico, sino que induce una ligera deformación del plano de triazina para crear una cavidad quiral dentro de la molécula contenedora. Este contenedor podría entonces utilizarse para catalizar asimétricamente una fotoadición [2+2] de maleimida y fluoranteno, un compuesto aromático inerte, que anteriormente no se había demostrado que experimentaran una reacción pericíclica térmica o fotoquímica. El catalizador produce un exceso enantiomérico del 40 %. [27]

Las enzimas también inspiraron un conjunto de ácidos de Bronsted confinados dentro de un bolsillo quiral extremadamente exigente estéricamente basado en un ácido bis(binaftil) imidodifosfórico C2 - simétrico. Dentro del microambiente quiral, los catalizadores tienen un sitio activo bifuncional geométricamente fijo que activa tanto una parte electrofílica como una parte nucleófila de un sustrato. Este catalizador permite la formación estereoselectiva de espiroacetal con un alto exceso enantiomérico para una variedad de sustratos. [28]

Los contenedores supramoleculares no sólo tienen una aplicación en la catálisis, sino también en el caso inverso, es decir, en la inhibición. Una molécula contenedora podría encapsular una molécula huésped y, por lo tanto, hacer que ésta deje de ser reactiva. Un mecanismo de inhibición podría ser que el sustrato esté completamente aislado del reactivo o que la molécula contenedora desestabilice el estado de transición de la reacción.
Nitschke y sus colaboradores inventaron un huésped supramolecular autoensamblable M 4 L 6 con una cavidad hidrofóbica tetraédrica que puede encapsular fósforo blanco . El fósforo pirofórico , que podría autocombustirse al entrar en contacto con el aire, se vuelve estable al aire dentro de la cavidad. Aunque el orificio en la cavidad es lo suficientemente grande para que entre una molécula de oxígeno, el estado de transición de la combustión es demasiado grande para caber dentro de la pequeña cavidad de la jaula. [29]

Después de muchas décadas desde su creación, la aplicación de la química supramolecular en la catálisis práctica sigue siendo difícil de alcanzar. La catálisis supramolecular aún no ha hecho una contribución significativa en el área de la química industrial o la metodología sintética. [20] A continuación se presentan algunos problemas asociados con este campo.
En muchos sistemas catalíticos supramoleculares diseñados para funcionar con reacciones de adición bimolecular como la de Diels-Alder, el producto de la reacción se une al huésped supramolecular con mayor fuerza que los dos sustratos, lo que provoca una inhibición por parte del producto. Como resultado, estos catalizadores tienen un número de recambio de uno y no son verdaderamente catalíticos. Se necesita una cantidad estequiométrica de catalizadores para una conversión completa. [30]
La mayoría de los catalizadores supramoleculares se desarrollan a partir de bloques de construcción rígidos porque estos últimos son menos complicados que las piezas flexibles a la hora de construir una forma deseada y colocar grupos funcionales donde el diseñador quiere. Sin embargo, debido a la rigidez, un ligero desajuste con respecto al estado de transición conduce inevitablemente a una mala estabilización y, por lo tanto, a una mala catálisis. En la naturaleza, las enzimas son flexibles y podrían cambiar sus estructuras para unirse a un estado de transición mejor que su forma nativa. [20]
La síntesis de catalizadores complejos de gran tamaño consume mucho tiempo y recursos. Una desviación inesperada del diseño podría ser desastrosa. Una vez que se descubre un catalizador, la modificación para realizar ajustes adicionales podría resultar tan difícil desde el punto de vista sintético que sería más fácil estudiar el catalizador deficiente que mejorarlo. [20]