
Las células protectoras son células vegetales especializadas en la epidermis de hojas, tallos y otros órganos que se utilizan para controlar el intercambio de gases. Se producen en pares con un espacio entre ellos que forma un poro estomático . Los poros estomáticos son más grandes cuando hay agua disponible libremente y las células protectoras se vuelven turgentes , y se cierran cuando la disponibilidad de agua es críticamente baja y las células protectoras se vuelven flácidas. La fotosíntesis depende de la difusión de dióxido de carbono (CO 2 ) desde el aire a través de los estomas hacia los tejidos del mesófilo . El oxígeno (O 2 ), producido como subproducto de la fotosíntesis, sale de la planta a través de los estomas. Cuando los estomas están abiertos, el agua se pierde por evaporación y debe reponerse mediante la corriente de transpiración , siendo el agua absorbida por las raíces. Las plantas deben equilibrar la cantidad de CO 2 absorbida del aire con la pérdida de agua a través de los poros estomáticos, y esto se logra mediante el control activo y pasivo de la presión de turgencia de las células protectoras y el tamaño de los poros estomáticos. [1] [2] [3] [4]
Las células protectoras son células que rodean cada estoma . Ayudan a regular la tasa de transpiración abriendo y cerrando los estomas. La luz es el principal disparador de la apertura o el cierre. Cada célula protectora tiene una cutícula relativamente gruesa y delgada en el lado del poro y otra delgada en el lado opuesto. A medida que el agua entra en la célula, el lado delgado sobresale hacia afuera como un globo y arrastra el lado grueso con él, formando una media luna; las medias lunas combinadas forman la apertura del poro.
Las células protectoras contienen proteínas fototropina que son serina y treonina quinasas con actividad fotorreceptora de luz azul. Las fototrofinas contienen dos dominios de sensor de luz, oxígeno y voltaje (LOV) y son parte de la superfamilia de dominios PAS . [5] Las fototropinas desencadenan muchas respuestas, como el fototropismo, el movimiento de los cloroplastos y la expansión de las hojas, así como la apertura de los estomas. [5] No se sabía mucho sobre cómo funcionaban estos fotorreceptores antes de 1998 aproximadamente. El mecanismo por el cual funcionan las fototropinas se aclaró a través de experimentos con habas ( Vicia faba ). La inmunodetección y la transferencia de Far Western mostraron que la luz azul excita la fototropina 1 y la fototropina 2, lo que hace que la proteína fosfatasa 1 comience una cascada de fosforilación, que activa la H + -ATPasa, una bomba responsable de bombear iones H + fuera de la célula. [3] La H + -ATPasa fosforilada permite la unión de una proteína 14-3-3 a un dominio autoinhibidor de la H + -ATPasa en el extremo C terminal. [6] La serina y la treonina luego se fosforilan dentro de la proteína, lo que induce la actividad H + -ATPasa. [5] El mismo experimento también encontró que tras la fosforilación, una proteína 14-3-3 se unía a las fototropinas antes de que la H + -ATPasa hubiera sido fosforilada. [5] En un experimento similar concluyeron que la unión de la proteína 14-3-3 al sitio de fosforilación es esencial para la activación de la actividad H + -ATPasa de la membrana plasmática. [6] Esto se hizo añadiendo fosfopéptidos como el P-950, que inhibe la unión de la proteína 14-3-3, a la H + -ATPasa fosforilada y observando la secuencia de aminoácidos. A medida que se bombean protones, se forma un potencial eléctrico negativo a través de la membrana plasmática. Esta hiperpolarización de la membrana permitió la acumulación de iones de potasio (K + ) e iones de cloruro (Cl- ) cargados , lo que a su vez aumenta la concentración de soluto provocando que el potencial hídrico disminuya. El potencial hídrico negativo permite que se produzca ósmosis en la célula protectora, de modo que entre agua, permitiendo que la célula se vuelva turgente. [ cita necesaria ]
La apertura y el cierre del poro estomático están mediados por cambios en la presión de turgencia de las dos células protectoras. La presión de turgencia de las células protectoras está controlada por movimientos de grandes cantidades de iones y azúcares dentro y fuera de las células protectoras. Las células protectoras tienen paredes celulares de espesor variable (su región interna, adyacente al poro estomático, es más gruesa y altamente cutinizada [7] ) y microfibras de celulosa orientadas de manera diferente, lo que hace que se doblen hacia afuera cuando están turgentes, lo que a su vez hace que los estomas se doblen hacia afuera. abierto. Los estomas se cierran cuando hay una pérdida osmótica de agua, que se produce por la pérdida de K + hacia las células vecinas, principalmente iones potasio (K + ). [8] [9] [10]
El estrés hídrico (sequía y estrés salino) es uno de los principales problemas ambientales que causan graves pérdidas en la agricultura y la naturaleza. La tolerancia de las plantas a la sequía está mediada por varios mecanismos que trabajan juntos, incluida la estabilización y protección de la planta del daño causado por la desecación y también el control de la cantidad de agua que las plantas pierden a través de los poros estomáticos durante la sequía. Una hormona vegetal, el ácido abscísico (ABA), se produce en respuesta a la sequía. Se ha identificado un tipo importante de receptor ABA. [11] [12] La hormona vegetal ABA hace que los poros estomáticos se cierren en respuesta a la sequía, lo que reduce la pérdida de agua de las plantas a través de la transpiración a la atmósfera y permite que las plantas eviten o ralenticen la pérdida de agua durante las sequías. El uso de plantas de cultivo tolerantes a la sequía conduciría a una reducción de las pérdidas de cultivos durante las sequías. [ cita necesaria ] Dado que las células protectoras controlan la pérdida de agua de las plantas, la investigación sobre cómo se regula la apertura y el cierre de los estomas podría conducir al desarrollo de plantas que eviten o ralenticen mejor la desecación y una mejor eficiencia en el uso del agua . [1]
ABA es el desencadenante del cierre de la abertura estomática. Para desencadenarlo, activa la liberación de aniones e iones de potasio. Esta entrada de aniones provoca una despolarización de la membrana plasmática. Esta despolarización hace que los iones potasio plus de la célula abandonen la célula debido al desequilibrio en el potencial de membrana. Este cambio repentino en las concentraciones de iones hace que la célula protectora se contraiga, lo que hace que los estomas se cierren, lo que a su vez disminuye la cantidad de agua perdida. Todo esto es una reacción en cadena según su investigación. El aumento de ABA provoca un aumento en la concentración de iones calcio. Aunque al principio pensaron que era una coincidencia, luego descubrieron que este aumento de calcio es importante. Descubrieron que los iones Ca2+ están involucrados en la activación del canal aniónico, lo que permite que los aniones fluyan hacia la célula protectora. También participan en la prohibición de que la ATPasa de protones corrija y detenga la despolarización de la membrana. Para respaldar su hipótesis de que el calcio era responsable de todos estos cambios en la célula, hicieron un experimento en el que utilizaron proteínas que inhibían la producción de iones de calcio. Si supusieran que el calcio es importante en estos procesos, verían que con los inhibidores verían menos de las siguientes cosas. Su suposición era correcta y cuando se utilizaron los inhibidores vieron que el protón ATPasa funcionaba mejor para equilibrar la despolarización. También descubrieron que el flujo de aniones hacia las células protectoras no era tan fuerte. Esto es importante para que los iones fluyan hacia la celda de guardia. Estas dos cosas son cruciales para hacer que la abertura de los estomas se cierre evitando la pérdida de agua de la planta. [13]
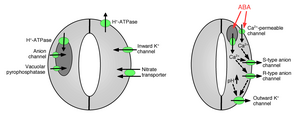
La absorción de iones por las células de guardia provoca la apertura de los estomas: la apertura de los poros de intercambio de gases requiere la absorción de iones de potasio por las células de guardia. Se han identificado canales y bombas de potasio y se ha demostrado que funcionan en la captación de iones y la apertura de aberturas estomáticas. [1] [14] [15] [16] [17] [18] [19] [20] La liberación de iones de las células protectoras provoca el cierre de los poros estomáticos: se han identificado otros canales iónicos que median la liberación de iones de las células protectoras, que produce un flujo de agua osmótica desde las células protectoras debido a la ósmosis , la contracción de las células protectoras y el cierre de los poros estomáticos (Figuras 1 y 2). Los canales de salida de potasio especializados participan en la mediación de la liberación de potasio desde las células protectoras. [16] [21] [22] [23] [24] Los canales aniónicos fueron identificados como controladores importantes del cierre estomático. [25] [26] [27] [28] [29] [30] [31] Los canales aniónicos tienen varias funciones principales en el control del cierre de los estomas: [26] (a) Permiten la liberación de aniones, como cloruro y malato de células de guarda, que son necesarias para el cierre de los estomas. (b) Los canales aniónicos se activan mediante señales que provocan el cierre de los estomas, por ejemplo, mediante calcio intracelular y ABA. [26] [29] [32] La liberación resultante de aniones cargados negativamente de las células protectoras da como resultado un cambio eléctrico de la membrana a voltajes más positivos ( despolarización ) en la superficie intracelular de la membrana plasmática de las células protectoras . Esta despolarización eléctrica de las células protectoras conduce a la activación de los canales de potasio de salida y a la liberación de potasio a través de estos canales. Se han caracterizado al menos dos tipos principales de canales aniónicos en la membrana plasmática: canales aniónicos tipo S y canales aniónicos tipo R. [25] [26] [28] [33]
Las vacuolas son grandes orgánulos de almacenamiento intracelular en las células vegetales. Además de los canales iónicos en la membrana plasmática, los canales iónicos vacuolares tienen funciones importantes en la regulación de la apertura y cierre de los estomas porque las vacuolas pueden ocupar hasta el 90% del volumen de las células protectoras. Por lo tanto, la mayoría de los iones se liberan de las vacuolas cuando los estomas están cerrados. [34] Los canales vasculares de K + (VK) y los canales vacuolares rápidos pueden mediar la liberación de K + de las vacuolas. [35] [36] [37] Los canales vacuolares de K + (VK) se activan mediante la elevación de la concentración de calcio intracelular. [35] Otro tipo de canal activado por calcio es el canal vacuolar lento (SV). [38] Se ha demostrado que los canales SV funcionan como canales catiónicos que son permeables a los iones Ca 2+ , [35] pero sus funciones exactas aún no se conocen en las plantas. [39]
Las celdas de protección controlan el intercambio de gases y de iones mediante apertura y cierre. K+ es un ion que fluye dentro y fuera de la célula, provocando que se desarrolle una carga positiva. El malato es uno de los principales aniones utilizados para contrarrestar esta carga positiva y se mueve a través del canal iónico AtALMT6. [40] AtALMT6 es un transportador de malato activado por aluminio que se encuentra en las células protectoras, específicamente en las vacuolas. Se descubrió que este canal de transporte provoca una entrada o una salida de malato dependiendo de las concentraciones de calcio. [40] En un estudio realizado por Meyer et al, se realizaron experimentos de abrazadera de parche en vacuolas de mesófilo de arabidopsis rdr6-11 (WT) y arabidopsis que sobreexpresaban AtALMT6-GFP. [40] A partir de estos experimentos se descubrió que en el WT solo había pequeñas corrientes cuando se introducían iones de calcio, mientras que en el mutante AtALMT6-GFP se observó una enorme corriente rectificadora hacia adentro. [40] Cuando el transportador es eliminado de las vacuolas de las células protectoras, se produce una reducción significativa en la corriente de flujo de malato. La corriente pasa de una enorme corriente entrante a no muy diferente a la WT, y Meyer et al plantearon la hipótesis de que esto se debe a concentraciones residuales de malato en la vacuola. [40] También hay una respuesta similar en los mutantes knockout a la sequía como en el WT. No se observaron diferencias fenotípicas entre los mutantes knockout, el tipo salvaje o los mutantes AtALMT6-GFP, y la causa exacta de esto no se conoce completamente. [40]
Las células protectoras perciben y procesan estímulos ambientales y endógenos como la luz, la humedad, la concentración de CO2 , la temperatura, la sequía y las hormonas vegetales para desencadenar respuestas celulares que dan como resultado la apertura o el cierre de los estomas. Estas vías de transducción de señales determinan, por ejemplo, la rapidez con la que una planta perderá agua durante un período de sequía. Las células de guardia se han convertido en un modelo de señalización unicelular. Utilizando Arabidopsis thaliana , la investigación del procesamiento de señales en células protectoras individuales se ha abierto al poder de la genética . [29] Se han identificado proteínas citosólicas y nucleares y mensajeros químicos que funcionan en los movimientos estomáticos y que median en la transducción de señales ambientales, controlando así la ingesta de CO 2 en las plantas y la pérdida de agua de las plantas. [1] [2] [3] [4] La investigación sobre los mecanismos de transducción de señales de las células protectoras está generando una comprensión de cómo las plantas pueden mejorar su respuesta al estrés por sequía al reducir la pérdida de agua. [1] [41] [42] Las células de guarda también proporcionan un modelo excelente para estudios básicos sobre cómo una célula integra numerosos tipos de señales de entrada para producir una respuesta (apertura o cierre de estomas). Estas respuestas requieren la coordinación de numerosos procesos biológicos celulares en las células protectoras, incluida la recepción de señales, la regulación de la bomba y el canal iónico, el tráfico de membranas , la transcripción , los reordenamientos citoesqueléticos y más. Un desafío para futuras investigaciones es asignar las funciones de algunas de las proteínas identificadas a estos diversos procesos biológicos celulares. [ cita necesaria ]
Durante el desarrollo de las hojas de las plantas, las células protectoras especializadas se diferencian de las "células madre protectoras". [43] [44] La densidad de los poros estomáticos en las hojas está regulada por señales ambientales, incluido el aumento de la concentración de CO 2 atmosférico , que reduce la densidad de los poros estomáticos en la superficie de las hojas en muchas especies de plantas mediante mecanismos actualmente desconocidos. La genética del desarrollo de los estomas se puede estudiar directamente mediante la obtención de imágenes de la epidermis de la hoja con un microscopio. Se han identificado varias proteínas de control importantes que funcionan en una vía que media el desarrollo de células protectoras y los poros estomáticos. [35] [44]