
En química de coordinación , la primera esfera de coordinación se refiere al conjunto de moléculas e iones (los ligandos ) unidos directamente al átomo central de metal . La segunda esfera de coordinación consta de moléculas e iones que se unen de diversas maneras a la primera esfera de coordinación.
La primera esfera de coordinación se refiere a las moléculas que están unidas directamente al metal. Las interacciones entre la primera y la segunda esfera de coordinación suelen implicar enlaces de hidrógeno. En el caso de los complejos cargados, el apareamiento iónico es importante.
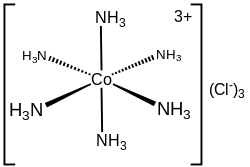
En el cloruro de hexamminocobalto(III) ([Co(NH 3 ) 6 ]Cl 3 ), el catión cobalto más los 6 ligandos de amoníaco forman la primera esfera de coordinación. La esfera de coordinación de este ion consiste, por tanto, en un núcleo central MN 6 "decorado" por 18 enlaces N−H que irradian hacia el exterior.

Los iones metálicos pueden describirse como compuestos por una serie de dos esferas de coordinación concéntricas, la primera y la segunda. Más distantes de la segunda esfera de coordinación, las moléculas de disolvente se comportan más como un " disolvente en masa ". La simulación de la segunda esfera de coordinación es de interés en la química computacional . La segunda esfera de coordinación puede consistir en iones (especialmente en complejos cargados), moléculas (especialmente aquellas que se unen mediante enlaces de hidrógeno a ligandos en la primera esfera de coordinación) y porciones de una cadena principal de ligando. En comparación con la primera esfera de coordinación, la segunda esfera de coordinación tiene una influencia menos directa en la reactividad y las propiedades químicas del complejo metálico. No obstante, la segunda esfera de coordinación es relevante para comprender las reacciones del complejo metálico, incluidos los mecanismos de intercambio de ligandos y catálisis.
Los mecanismos de las metaloproteínas a menudo invocan la modulación de la segunda esfera de coordinación por parte de la proteína. [1]

Las velocidades a las que los ligandos se intercambian entre la primera y la segunda esfera de coordinación es el primer paso en las reacciones de sustitución de ligando. En la sustitución asociativa de ligando , el nucleófilo entrante reside en la segunda esfera de coordinación. Estos efectos son relevantes para aplicaciones prácticas como los agentes de contraste utilizados en la resonancia magnética . [4]
La energética de las reacciones de transferencia de electrones de la esfera interna se analiza en términos de la segunda esfera de coordinación. Algunas reacciones de transferencia de electrones acopladas a protones implican la transferencia de átomos entre las segundas esferas de coordinación de los reactivos:
Los efectos de los disolventes sobre los colores y la estabilidad suelen atribuirse a cambios en la segunda esfera de coordinación. Dichos efectos pueden ser pronunciados en complejos en los que los ligandos en la primera esfera de coordinación son fuertes donantes y aceptores de enlaces de hidrógeno, por ejemplo, respectivamente [Co(NH 3 ) 6 ] 3+ y [Fe(CN) 6 ] 3− . Los éteres corona se unen a los complejos de poliamina a través de su segunda esfera de coordinación. Los cationes de poliamonio se unen a los centros de nitrógeno de los cianometalatos. [5]
Las moléculas macrocíclicas como las ciclodextrinas actúan a menudo como la segunda esfera de coordinación para los complejos metálicos. [6] [7]