Ácidos carboranos H(CXB
11Y
5O
6) (X, Y, Z = H, Alk, F, Cl, Br, CF 3 ) son una clase de superácidos , [1] algunos de los cuales se estima que son al menos un millón de veces más fuertes que el ácido sulfúrico 100% puro en términos de sus valores de función de acidez de Hammett ( H 0 ≤ –18) y poseen valores de p K a calculados muy por debajo de –20, lo que los establece como algunos de los ácidos de Brønsted más fuertes conocidos. [2] [3] [4] El ejemplo mejor estudiado es el derivado altamente clorado H(CHB
11Cl
11) . La acidez de H(CHB
11Cl
11) superó ampliamente al del ácido tríflico , CF
3ENTONCES
3H , y bistriflimida , (CF
3ENTONCES
2)
2NH , compuestos anteriormente considerados como los ácidos aislables más fuertes.
Su alta acidez se debe a la extensa deslocalización de sus bases conjugadas, los aniones carboranato (CXB 11 Y 5 Z 6 − ), que generalmente se estabilizan aún más mediante grupos electronegativos como Cl, F y CF 3 . Debido a la falta de propiedades oxidantes y la nucleofilia excepcionalmente baja y la alta estabilidad de sus bases conjugadas, son los únicos superácidos conocidos que protonan el fulereno C 60 sin descomponerlo. [5] [6] Además, forman sales estables y aislables con benceno protonado , C 6 H 7 + , el compuesto original de los intermediarios de Wheland encontrados en reacciones de sustitución aromática electrofílica .
El ácido carborano fluorado, H(CHB
11F
11) , es incluso más fuerte que el ácido carborano clorado. Es capaz de protonar butano para formar catión terc -butilo a temperatura ambiente y es el único ácido conocido que protona dióxido de carbono para dar el catión puente, [H(CO
2)
2]+
, lo que lo convierte posiblemente en el ácido más fuerte conocido. En particular, el CO 2 no sufre una protonación observable cuando se trata con los superácidos mixtos HF-SbF 5 o HSO 3 F-SbF 5 . [7] [8] [9]
Como clase, los ácidos carboranos forman el grupo más ácido de sustancias bien definidas y aislables conocidas, mucho más ácidos que los ácidos fuertes de un solo componente conocidos anteriormente, como el ácido tríflico o el ácido perclórico . En ciertos casos, como los derivados casi perhalogenados mencionados anteriormente, sus acideces rivalizan (y posiblemente superan) las de los superácidos Lewis-Brønsted mixtos tradicionales, como el ácido mágico y el ácido fluoroantimónico . (Sin embargo, hasta ahora no ha sido posible una comparación directa, debido a la falta de una medida de acidez que sea adecuada para ambas clases de ácidos: los valores de p K a están mal definidos para los ácidos mixtos químicamente complejos, mientras que los valores de H 0 no se pueden medir para los ácidos carboranos de punto de fusión muy alto).

La fuerza de un ácido de Brønsted-Lowry se corresponde con su capacidad para liberar un ion hidrógeno. Una medida común de la fuerza del ácido para medios líquidos superácidos concentrados es la función de acidez de Hammett, H 0 . Basándose en su capacidad para protonar cuantitativamente el benceno, el ácido carborano clorado H(CHB
11Cl
11) se estimó de manera conservadora que tenía un valor de H 0 igual o inferior a −18, lo que llevó a la afirmación común de que los ácidos de carborano son al menos un millón de veces más fuertes que el ácido sulfúrico al 100% ( H 0 = −12). [11] [12] Sin embargo, dado que el valor de H 0 mide la capacidad de protonación de un medio líquido , la naturaleza cristalina y de alto punto de fusión de estos ácidos impide la medición directa de este parámetro. En términos de p K a , una medida ligeramente diferente de la acidez definida como la capacidad de un soluto dado de sufrir ionización en un disolvente, se estima que los ácidos de carborano tienen valores de p K a inferiores a −20, incluso sin sustituyentes que atraen electrones en los átomos de boro (por ejemplo, H(CHB
11yo
11) tiene un p K a de −24), [13] con el análogo completamente fluorado (aún desconocido) H(CB
11F
12) que tiene un p K a calculado de −46. [4] El ácido conocido H(CHB
11F
11) con un flúor menos se espera que sea sólo ligeramente más débil (p K a < −40).
En la fase gaseosa, H(CHB
11F
11) tiene una acidez calculada de 216 kcal/mol, en comparación con una acidez determinada experimentalmente de 241 kcal/mol (en razonable acuerdo con el valor calculado de 230 kcal/mol) para H(CHB
11Cl
11) . Por el contrario, HSbF 6 (un modelo simplificado para las especies donadoras de protones en el ácido fluoroantimónico ) tiene una acidez en fase gaseosa calculada de 255 kcal/mol, mientras que el poseedor del récord determinado experimentalmente anteriormente era (C 4 F 9 SO 2 ) 2 NH, un congénere de la bistriflimida , con 291 kcal/mol. Por lo tanto, H(CHB
11F
11) es probablemente la sustancia más ácida sintetizada hasta ahora en masa, en términos de su acidez en fase gaseosa. En vista de su reactividad única, también es un fuerte candidato para ser la sustancia más ácida en la fase condensada (ver arriba). Se han predicho algunos derivados aún más fuertemente ácidos, con acideces en fase gaseosa < 200 kcal/mol. [14] [15]
Los ácidos carboranos se diferencian de los superácidos clásicos en que son sustancias monocomponentes bien definidas. Por el contrario, los superácidos clásicos suelen ser mezclas de un ácido de Brønsted y un ácido de Lewis (p. ej., HF/SbF 5 ). [6] A pesar de ser el ácido más fuerte, los ácidos carboranos a base de boro se describen como "suaves", ya que protonan de forma limpia sustancias débilmente básicas sin más reacciones secundarias. [16] Mientras que los superácidos convencionales descomponen los fulerenos debido a su componente ácido de Lewis fuertemente oxidante, el ácido carborano tiene la capacidad de protonar los fulerenos a temperatura ambiente para producir una sal aislable. [17] [6] Además, el anión que se forma como resultado de la transferencia de protones es casi completamente inerte. Esta propiedad es lo que hace que los ácidos carboranos sean las únicas sustancias que son comparables en acidez a los superácidos mixtos que también se pueden almacenar en una botella de vidrio, ya que no están presentes ni se generan varias especies donadoras de flúor (que atacan el vidrio). [18] [17]
El ácido carborano fue descubierto y sintetizado por primera vez por el profesor Christopher Reed y sus colegas en 2004 en la Universidad de California, Riverside. [6] La molécula madre de la que se deriva el ácido carborano, un anión carboranato icosaédrico, HCB
11yo−
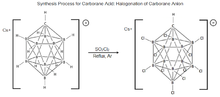
11, fue sintetizado por primera vez en DuPont en 1967 por Walter Knoth. La investigación sobre las propiedades de esta molécula se suspendió hasta mediados de la década de 1980, cuando el grupo checo de científicos del boro, Plešek, Štíbr y Heřmánek, mejoró el proceso de halogenación de las moléculas de carborano. Estos hallazgos fueron fundamentales para desarrollar el procedimiento actual para la síntesis del ácido carborano. [17] [19] El proceso consiste en tratar Cs + [HCB 11 H 11 ] − con SO
2Cl
2, refluyendo bajo argón seco para clorar completamente la molécula produciendo ácido carborano, pero se ha demostrado que esto clora completamente solo en condiciones seleccionadas. [20] [17] [21]
En 2010, Reed publicó una guía que proporcionaba procedimientos detallados para la síntesis de ácidos carboranos y sus derivados. [22] Sin embargo, la síntesis de ácidos carboranos sigue siendo larga y difícil y requiere una caja de guantes bien mantenida y algunos equipos especializados. El material de partida es el decaborano (14) disponible comercialmente , una sustancia altamente tóxica. El ácido carborano más estudiado es el H(CHB
11Cl
11) se prepara en 13 pasos. Los últimos pasos son especialmente sensibles y requieren una caja de guantes a < 1 ppm de H 2 O sin vapores de disolventes débilmente básicos, ya que las bases tan débiles como el benceno o el diclorometano reaccionarán con electrófilos basados en carborano y ácidos de Brønsted. El paso final de la síntesis es la metátesis de la sal de carboranato de μ-hidridodisililio con exceso de cloruro de hidrógeno anhidro líquido, presumiblemente impulsada por la formación de fuertes enlaces Si–Cl y H–H en los subproductos volátiles:
El producto se aisló por evaporación de los subproductos y se caracterizó por sus espectros infrarrojos (ν CH = 3023 cm −1 ) y de resonancia magnética nuclear (δ 4,55 (s, 1H, CH), 20,4 (s, 1H, H + ) en SO 2 líquido ) (nótese el desplazamiento químico extremadamente descendente del protón ácido). [22] Aunque las reacciones utilizadas en la síntesis son análogas, la obtención de una muestra pura del H(CHB
11F
11) resultó ser aún más difícil y requirió procedimientos extremadamente rigurosos para excluir trazas de impurezas débilmente básicas. [7]
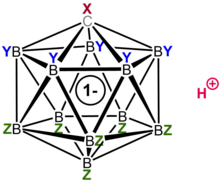
El ácido carborano está formado por 11 átomos de boro; cada átomo de boro está unido a un átomo de cloro. Los átomos de cloro sirven para mejorar la acidez y actúan como escudos contra ataques desde el exterior debido al impedimento estérico que forman alrededor del grupo. El grupo, formado por los 11 boros, 11 cloros y un solo átomo de carbono, está emparejado con un átomo de hidrógeno, unido al átomo de carbono. Los átomos de boro y carbono pueden formar seis enlaces debido a la capacidad del boro para formar enlaces de tres centros y dos electrones. [19]

Aunque la estructura del ácido carborano difiere mucho de la de los ácidos convencionales, ambos distribuyen la carga y la estabilidad de manera similar. El anión carborano distribuye su carga deslocalizando los electrones a lo largo de los 12 átomos de la jaula. [23] Esto se demostró en un estudio de difracción de rayos X de monocristal que reveló longitudes de enlace acortadas en la porción heterocíclica del anillo, lo que sugiere una deslocalización electrónica. [24]
El anión carba- closo -dodecaborato clorado HCB
11Cl−
11es un anión extraordinariamente estable con lo que previamente se ha descrito como vértices B–Cl "sustitucionalmente inertes".

El descriptor closo indica que la molécula se deriva formalmente (por reemplazo de B a C + ) de un borano de estequiometría y carga [B n H n ] 2− ( n = 12 para ácidos carboranos conocidos). [25] La estructura tipo jaula formada por los 11 átomos de boro y 1 átomo de carbono permite que los electrones estén altamente deslocalizados a través de la jaula 3D (la estabilización especial del sistema carborano se ha denominado "σ-aromaticidad"), y la alta energía requerida para interrumpir la porción del grupo de boro de la molécula es lo que le da al anión su notable estabilidad. [25] Debido a que el anión es extremadamente estable, no se comportará como un nucleófilo hacia el sustrato protonado, mientras que el ácido en sí es completamente no oxidante, a diferencia de los componentes ácidos de Lewis de muchos superácidos como el pentafluoruro de antimonio. Por lo tanto, las moléculas sensibles como C 60 pueden protonarse sin descomposición. [26] [27]
Existen muchas aplicaciones propuestas para los ácidos carboranos basados en boro. Por ejemplo, se han propuesto como catalizadores para el craqueo de hidrocarburos y la isomerización de n -alcanos para formar isoalcanos ramificados ("isooctano", por ejemplo). Los ácidos carboranos también se pueden utilizar como ácidos de Brønsted selectivos y fuertes para la síntesis química fina, donde la baja nucleofilia del contraanión puede ser ventajosa. En la química orgánica mecanicista, se pueden utilizar en el estudio de intermediarios catiónicos reactivos. [28] En la síntesis inorgánica, su acidez incomparable puede permitir el aislamiento de especies exóticas como sales de xenón protonado. [18] [19] [29]