Se conocen 40 isótopos de yodo ( 53 I), desde 108 I hasta 147 I; todos sufren desintegración radiactiva excepto el 127 I, que es estable. El yodo es, por tanto, un elemento monoisotópico .
Su isótopo radiactivo de vida más larga , el 129 I, tiene una vida media de 16,14 millones de años, que es demasiado corta para que exista como un nucleido primordial . Las fuentes cosmogénicas de 129 I producen cantidades muy pequeñas de este elemento que son demasiado pequeñas para afectar las mediciones del peso atómico; por lo tanto, el yodo también es un elemento mononucleídico , es decir, que se encuentra en la naturaleza solo como un nucleido único. La mayor parte de la radiactividad derivada del 129 I en la Tierra es de origen humano, un subproducto no deseado de larga duración de las primeras pruebas nucleares y los accidentes de fisión nuclear.
Todos los demás radioisótopos del yodo tienen vidas medias inferiores a 60 días, y cuatro de ellos se utilizan como trazadores y agentes terapéuticos en medicina. Se trata del 123I , 124I , 125I y 131I . Toda la producción industrial de isótopos radiactivos del yodo implica estos cuatro radionucleidos útiles.
El isótopo 135 I tiene una vida media inferior a siete horas, lo que es demasiado corto para su uso en biología. La inevitable producción in situ de este isótopo es importante para el control de los reactores nucleares, ya que se desintegra en 135 Xe, el absorbente de neutrones más potente conocido y el nucleido responsable del denominado fenómeno de la fosa de yodo .
Además de la producción comercial, el 131 I (con una vida media de 8 días) es uno de los productos de fisión radiactivos más comunes de la fisión nuclear y, por lo tanto, se produce inadvertidamente en grandes cantidades dentro de los reactores nucleares . Debido a su volatilidad, su corta vida media y su alta abundancia en los productos de fisión, el 131 I (junto con el isótopo de yodo de vida corta 132 I, que se produce a partir de la desintegración del 132 Te con una vida media de 3 días) es responsable de la mayor parte de la contaminación radiactiva durante la primera semana después de la contaminación ambiental accidental por los desechos radiactivos de una planta de energía nuclear. Por lo tanto, se administran suplementos de yodo en dosis altas (generalmente yoduro de potasio ) a la población después de accidentes o explosiones nucleares (y en algunos casos antes de cualquier incidente de este tipo como mecanismo de defensa civil ) para reducir la absorción de compuestos de yodo radiactivos por la tiroides antes de que los isótopos altamente radiactivos hayan tenido tiempo de desintegrarse.
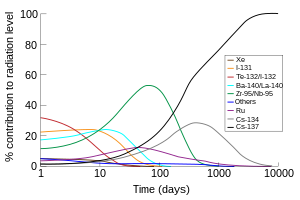
Los radioisótopos del yodo se denominan yodo radiactivo o yodo radiactivo . Existen docenas de ellos, pero alrededor de media docena son los más conocidos en ciencias aplicadas, como las ciencias biológicas y la energía nuclear, como se detalla a continuación. Las menciones al yodo radiactivo en contextos de atención médica se refieren con más frecuencia al yodo-131 que a otros isótopos.
De los muchos isótopos del yodo, sólo dos se utilizan habitualmente en el ámbito médico: el yodo-123 y el yodo-131. Dado que el 131I tiene un modo de desintegración beta y gamma, se puede utilizar para radioterapia o para la obtención de imágenes. El 123I , que no tiene actividad beta, es más adecuado para la obtención de imágenes de medicina nuclear de rutina de la tiroides y otros procesos médicos y es menos dañino internamente para el paciente. Hay algunas situaciones en las que el yodo-124 y el yodo-125 también se utilizan en medicina. [6]
Debido a la captación preferencial de yodo por la tiroides, el yodo radiactivo se utiliza ampliamente en la obtención de imágenes y, en el caso del 131 I, en la destrucción de tejidos tiroideos disfuncionales. Otros tipos de tejidos captan de forma selectiva ciertos agentes radiofarmacéuticos que contienen yodo-131 y que actúan sobre los tejidos y los destruyen (como la MIBG ). El yodo-125 es el único otro radioisótopo de yodo que se utiliza en radioterapia, pero solo como una cápsula implantada en braquiterapia , donde el isótopo nunca tiene la oportunidad de liberarse para la interacción química con los tejidos del cuerpo.
Los isótopos emisores de rayos gamma yodo-123 (vida media de 13 horas) y (con menor frecuencia) yodo-125 (vida media de 59 días), de vida más larga y menos energético, se utilizan como trazadores de imágenes nucleares para evaluar la función anatómica y fisiológica de la tiroides. Los resultados anormales pueden deberse a trastornos como la enfermedad de Graves o la tiroiditis de Hashimoto . Ambos isótopos se desintegran por captura de electrones (EC) en los nucleidos de telurio correspondientes , pero en ninguno de los casos se trata de los nucleidos metaestables 123m Te y 125m Te (que son de mayor energía y no se producen a partir del yodo radiactivo). En cambio, los nucleidos de telurio excitados se desintegran inmediatamente (vida media demasiado corta para detectarlos). Después de la EC, el 123 Te excitado a partir del 123 I emite un electrón de conversión interna de alta velocidad de 127 keV (no un rayo beta ) aproximadamente el 13 % del tiempo, pero esto causa poco daño celular debido a la corta vida media del nucleido y la fracción relativamente pequeña de tales eventos. En el resto de los casos, se emite un rayo gamma de 159 keV, que es adecuado para la obtención de imágenes gamma.
El 125 Te excitado resultante de la captura de electrones del 125 I también emite un electrón de conversión interna de energía mucho más baja (35,5 keV), que causa relativamente poco daño debido a su baja energía, aunque su emisión es más común. La gamma de energía relativamente baja de la desintegración del 125 I/ 125 Te no es adecuada para la obtención de imágenes, pero aún así se puede ver, y este isótopo de vida más larga es necesario en pruebas que requieren varios días de obtención de imágenes, por ejemplo, la obtención de imágenes mediante gammagrafía con fibrinógeno para detectar coágulos de sangre.
Tanto el 123 I como el 125 I emiten abundantes electrones Auger de baja energía después de su desintegración, pero estos no causan daños graves (roturas de ADN de doble cadena) en las células, a menos que el nucleido se incorpore a un medicamento que se acumula en el núcleo o en el ADN (esto nunca es el caso en la medicina clínica, pero se ha visto en modelos animales experimentales). [7]
El yodo-125 también es comúnmente utilizado por los oncólogos radioterapeutas en braquiterapia de baja tasa de dosis en el tratamiento del cáncer en sitios distintos de la tiroides, especialmente en el cáncer de próstata . Cuando se utiliza 125 I con fines terapéuticos, se encapsula en semillas de titanio y se implanta en el área del tumor, donde permanece. La baja energía del espectro gamma en este caso limita el daño por radiación a los tejidos alejados de la cápsula implantada. El yodo-125, debido a su vida media más larga adecuada y su espectro gamma menos penetrante, también se prefiere a menudo para pruebas de laboratorio que dependen del yodo como trazador que se cuenta mediante un contador gamma , como en el radioinmunoensayo .
El 125 I se utiliza como radiomarcador para investigar qué ligandos van a qué receptores de reconocimiento de patrones (PRR) de las plantas. [8]
El yodo-124 es un isótopo del yodo rico en protones con una vida media de 4,18 días. Sus modos de desintegración son: 74,4% captura de electrones, 25,6% emisión de positrones. El 124 I se desintegra en 124 Te. El yodo-124 se puede generar mediante numerosas reacciones nucleares a través de un ciclotrón . El material de partida más común utilizado es el 124 Te.
El yodo-124 como sal de yoduro se puede utilizar para obtener imágenes directas de la tiroides mediante tomografía por emisión de positrones (PET). [9] El yodo-124 también se puede utilizar como radiotrazador PET con una vida media útilmente más larga en comparación con el flúor-18 . [10] En este uso, el nucleido se une químicamente a un fármaco para formar un radiofármaco emisor de positrones y se inyecta en el cuerpo, donde nuevamente se obtiene una imagen mediante una tomografía por emisión de positrones.
El yodo-129 ( 129 I; vida media de 15,7 millones de años) es un producto de la espalación de rayos cósmicos en varios isótopos de xenón en la atmósfera , en la interacción de muones de rayos cósmicos con telurio-130, y también de la fisión de uranio y plutonio , tanto en rocas subterráneas como en reactores nucleares. Los procesos nucleares artificiales, en particular el reprocesamiento de combustible nuclear y las pruebas de armas nucleares atmosféricas, han inundado la señal natural de este isótopo. Sin embargo, ahora sirve como un trazador de aguas subterráneas como indicador de la dispersión de desechos nucleares en el medio ambiente natural. De manera similar, el 129 I se utilizó en estudios de agua de lluvia para rastrear productos de fisión después del desastre de Chernóbil .
En algunos aspectos, el 129 I es similar al 36 Cl . Es un halógeno soluble, existe principalmente como un anión no absorbente y se produce mediante reacciones cosmogénicas, termonucleares e in situ. En los estudios hidrológicos, las concentraciones de 129 I se informan generalmente como la relación entre el 129 I y el I total (que es prácticamente todo 127 I). Como es el caso con 36 Cl/Cl, las relaciones 129 I/I en la naturaleza son bastante pequeñas, de 10 −14 a 10 −10 (el pico termonuclear de 129 I/I durante los años 1960 y 1970 alcanzó aproximadamente 10 −7 ). El 129 I se diferencia del 36 Cl en que su vida media es más larga (15,7 frente a 0,301 millones de años), es altamente biofílico y se presenta en múltiples formas iónicas (comúnmente, I − e IO 3 − ), que tienen diferentes comportamientos químicos. Esto hace que sea bastante fácil para el 129 I entrar en la biosfera a medida que se incorpora a la vegetación, el suelo, la leche, el tejido animal, etc. Se ha demostrado que los excesos de 129 Xe estable en meteoritos son el resultado de la descomposición del yodo-129 "primordial" producido recientemente por las supernovas que crearon el polvo y el gas a partir de los cuales se formó el sistema solar. Este isótopo se ha desintegrado hace mucho tiempo y, por lo tanto, se lo conoce como "extinto". Históricamente, el 129 I fue el primer radionúclido extinto que se identificó como presente en el Sistema Solar primitivo . Su desintegración es la base del esquema de datación radiométrica de yodo-xenón I-Xe , que cubre los primeros 85 millones de años de evolución del Sistema Solar .

Yodo-131 (131
I
) es un isótopo emisor de beta con una vida media de ocho días y una radiación beta comparativamente energética (190 keV de media y 606 keV de energía máxima), que penetra de 0,6 a 2,0 mm desde el sitio de captación. Esta radiación beta se puede utilizar para la destrucción de nódulos tiroideos o tejido tiroideo hiperfuncionante y para la eliminación del tejido tiroideo restante después de la cirugía para el tratamiento de la enfermedad de Graves . El propósito de esta terapia, que fue explorada por primera vez por el Dr. Saul Hertz en 1941, [11] es destruir el tejido tiroideo que no se pudo extirpar quirúrgicamente. En este procedimiento, se administra 131 I por vía intravenosa u oral después de una exploración diagnóstica. Este procedimiento también se puede utilizar, con dosis más altas de yodo radiactivo, para tratar a pacientes con cáncer de tiroides .
El 131 I es absorbido por el tejido tiroideo y se concentra allí. Las partículas beta emitidas por el radioisótopo destruyen el tejido tiroideo asociado con poco daño a los tejidos circundantes (más de 2,0 mm de los tejidos que absorben el yodo). Debido a una destrucción similar, el 131 I es el radioisótopo de yodo utilizado en otros radiofármacos marcados con yodo solubles en agua (como MIBG ) que se utilizan terapéuticamente para destruir tejidos.
La radiación beta de alta energía (hasta 606 keV) del 131 I hace que sea el más cancerígeno de los isótopos de yodo. Se cree que causa la mayoría de los cánceres de tiroides excesivos observados después de la contaminación por fisión nuclear (como la lluvia radiactiva o los accidentes graves en reactores nucleares como el desastre de Chernóbil ). Sin embargo, estos efectos epidemiológicos se observan principalmente en niños, y el tratamiento de adultos y niños con 131 I terapéutico, y la epidemiología de los adultos expuestos a dosis bajas de 131 I no han demostrado carcinogenicidad. [12]
El yodo-135 es un isótopo del yodo con una vida media de 6,6 horas. Es un isótopo importante desde el punto de vista de la física de los reactores nucleares . Se produce en cantidades relativamente grandes como producto de fisión y se desintegra en xenón-135 , que es un veneno nuclear con la mayor sección eficaz de neutrones térmicos conocida , lo que es causa de múltiples complicaciones en el control de los reactores nucleares . El proceso de acumulación de xenón-135 a partir del yodo-135 acumulado puede impedir temporalmente que un reactor apagado se vuelva a poner en marcha. Esto se conoce como envenenamiento por xenón o "caída en un pozo de yodo ".
Los isótopos producidos por fisión del yodo que no se han analizado anteriormente (yodo-128, yodo-130, yodo-132 y yodo-133) tienen vidas medias de varias horas o minutos, lo que los vuelve casi inútiles en otras áreas aplicables. Los mencionados son ricos en neutrones y sufren desintegración beta a isótopos de xenón. El yodo-128 (vida media de 25 minutos) puede desintegrarse en telurio-128 por captura de electrones o en xenón-128 por desintegración beta. Tiene una radiactividad específica de2,177 × 10 6 TBq/g .
En términos coloquiales, los materiales radiactivos se pueden describir como "calientes" y los materiales no radiactivos como "fríos". Hay casos en los que se administra yoduro frío a personas para evitar la captación de yoduro caliente por la glándula tiroides. Por ejemplo, el bloqueo de la captación de yodo tiroideo con yoduro de potasio se utiliza en la gammagrafía de medicina nuclear y en la terapia con algunos compuestos radioyodados que no están dirigidos a la tiroides, como el iobenguano ( MIBG ), que se utiliza para obtener imágenes o tratar tumores del tejido neural, o el fibrinógeno yodado, que se utiliza en las exploraciones con fibrinógeno para investigar la coagulación. Estos compuestos contienen yodo, pero no en forma de yoduro. Sin embargo, dado que pueden metabolizarse en última instancia o descomponerse en yoduro radiactivo, es habitual administrar yoduro de potasio no radiactivo para garantizar que los metabolitos de estos radiofármacos no queden secuestrados por la glándula tiroides y administren inadvertidamente una dosis radiológica a ese tejido.
Se ha distribuido yoduro de potasio a poblaciones expuestas a accidentes de fisión nuclear , como el desastre de Chernóbil . La solución de yoduro SSKI , una solución saturada de yoduro de potasio ( K ) en agua, se ha utilizado para bloquear la absorción del yodo radiactivo (no tiene efecto sobre otros radioisótopos de la fisión). Algunos gobiernos también fabrican y almacenan tabletas que contienen yoduro de potasio en los sitios centrales de desastres con este fin. En teoría, muchos de los efectos cancerígenos tardíos nocivos de la lluvia radiactiva podrían evitarse de esta manera, ya que un exceso de cánceres de tiroides, presumiblemente debido a la absorción de yodo radiactivo, es el único efecto probado de contaminación por radioisótopos después de un accidente de fisión, o de contaminación por la lluvia radiactiva de una bomba atómica (la radiación inmediata de la bomba también causa otros cánceres, como leucemias, directamente). La ingestión de grandes cantidades de yoduro satura los receptores tiroideos y evita la captación de la mayor parte del yodo-131 radiactivo que puede estar presente por la exposición a los productos de fisión (aunque no protege de otros radioisótopos ni de ninguna otra forma de radiación directa). El efecto protector del KI dura aproximadamente 24 horas, por lo que debe administrarse diariamente hasta que ya no exista un riesgo significativo de exposición a los radioyodos de los productos de fisión. [13] [14] El yodo-131 (el contaminante de yodo radiactivo más común en la lluvia radiactiva) también se desintegra con relativa rapidez, con una vida media de ocho días, de modo que el 99,95% del yodo radiactivo original ha desaparecido después de tres meses.