Arino
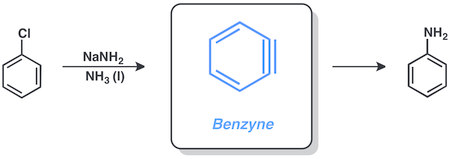
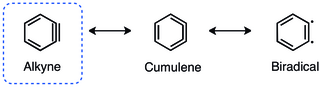
[1][2] La manera más habitual de representar un arino es mediante un triple enlace formal tensionado, sin embargo también es conocido su carácter dirradical o su estructura cumulénica.
Aunque el término arino se asocia comúnmente al orto-arino, 1,2-dideshidroareno, los dideshidroderivados 1,3- y 1,4- también son conocidos.
[3] La estructura más utilizada para respresentar los arinos consiste en un triple enlace formal tensionado, sin embargo sus formas resonantes dirradical o cumulénica, también han sido descritas.
Con todo, el alquino tensionado es la representación más adecuada de la naturaleza del triple enlace del orto-bencino, más que la dirradical (mayor gap entre los estados singlete y triplete y reactividad de tipo alquino).
[7] Las restricciones geométricas suponen igualmente una reducción significativa de la energía del LUMO de los arinos (desde 6.41 eV para el 2-butino hasta 1.33 eV en el bencino) mientras que la energía del HOMO permanece prácticamente constante según diversos estudios computacionales.
Se deduce por lo tanto que el bencino posee cierto carácter electrófilo y experimenta reacciones con nucleófilos.
Este resultado implica la formación de un intermedio simétrico, conocido ahora como bencino.
Estas reacciones generan un bencino que puede dar lugar a diversos derivados del benceno.
La generación del intermedio arínico suele ser la etapa lenta en este tipo de reacciones.
Si el arino (con un sustituyente en meta) se genera mediante el tratamiento con una base fuerte, será la acidez de los protones situados en orto al grupo saliente quien dirija la selectividad en generación del arino (no teniendo en cuenta factores estéricos).
Por tanto, si Y es un grupo aceptor de electrones, entonces HB es más ácido que HA dando lugar al regioisómero B.
En caso de que el triple enlace se encuentre entre los carbonos C2 y C3, sustituyentes aceptores de carga electrónica (electron withdrawing substituents EWG) dirigirán la adición nucleófila para formar el carbanión más cercano al EWG.
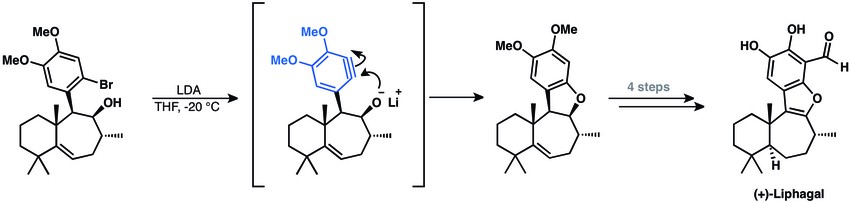
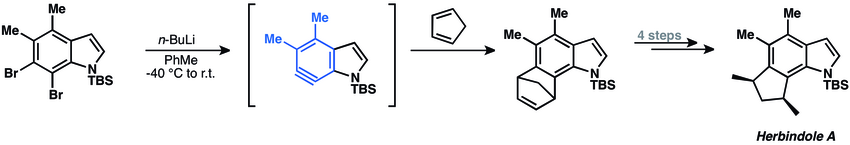
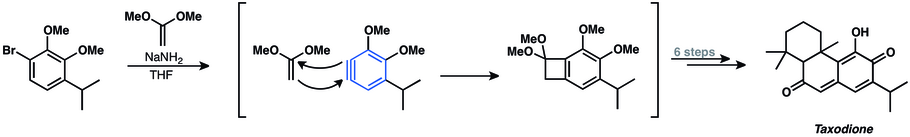
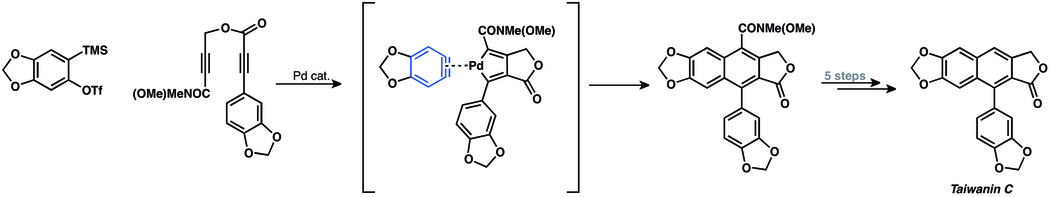
[28] Las adiciones nucleófilas a arinos han sido ampliamente utilizadas en la síntesis de productos naturales.
La aproximación sintética implica una ciclación con un arino para cerrar el anillo heterocíclico del producto natural.
La síntesis del dehidroaltenueno B se realiza mediante una reacción multicomponente de arinos.
Aun así, posiblemente muchas cicloadiciones [4+2] podrían tener lugar a través un mecanismo por etapas.
El primer ejemplo de inserción en enlace σ se tiene en la síntesis del compuesto mellein en 1973.
En un expermiento clásico con 1,4-dideshidrobenceno, al calentar a 300 °C, el confórmero [1,6-D2]-A se equilibra rápidamente con el [3,2-D2]-B pero no lo hace con C o con D. La migración simultánea de deuterio a la forma B, y el hecho de que ni C ni D se formen, sólo se puede explicar por la presencia de un intermedio cíclico y simétrico como el 1,4-dideshidrobenceno.