En la ciencia nuclear, una cadena de desintegración se refiere a la serie predecible de desintegraciones radiactivas que experimentan los núcleos de ciertos elementos químicos inestables.
Los isótopos radiactivos no suelen desintegrarse directamente en isótopos estables , sino en otro radioisótopo. El isótopo producido por esta emisión radiactiva se desintegra a su vez en otro isótopo, a menudo radiactivo. Esta cadena de desintegraciones siempre termina en un isótopo estable , cuyo núcleo ya no tiene el excedente de energía necesario para producir otra emisión de radiación. Se dice entonces que dichos isótopos estables tienen núcleos que han alcanzado sus estados fundamentales .
Las etapas o pasos en una cadena de desintegración se conocen por su relación con etapas anteriores o posteriores. Por lo tanto, un isótopo padre es uno que sufre una desintegración para formar un isótopo hijo . Por ejemplo, el elemento 92, uranio , tiene un isótopo con 143 neutrones ( 236 U ) y se desintegra en un isótopo del elemento 90, torio , con 142 neutrones ( 232 Th ). El isótopo hijo puede ser estable o puede desintegrarse para formar otro isótopo hijo. El 232 Th hace esto cuando se desintegra en radio-228 . La hija de un isótopo hijo, como el 228 Ra, a veces se denomina isótopo nieta .
El tiempo que tarda un átomo de un isótopo padre en desintegrarse en su isótopo hijo es fundamentalmente impredecible y varía ampliamente. En el caso de los núcleos individuales, no se sabe que el proceso tenga causas determinables y, por lo tanto, el momento en que ocurre es completamente aleatorio . La única predicción que se puede hacer es estadística y expresa una tasa media de desintegración. Esta tasa se puede representar ajustando la curva de una distribución exponencial de desintegración con una constante de desintegración ( λ ) particular para el isótopo. Según este entendimiento, la desintegración radiactiva de una población inicial de átomos inestables a lo largo del tiempo t sigue la curva dada por e − λt .
De este análisis se desprende una de las propiedades más importantes de cualquier material radiactivo: su vida media , que se refiere al tiempo que tarda en desintegrarse la mitad de un número determinado de átomos radiactivos y está inversamente relacionada con la constante de desintegración del isótopo, λ . Se han determinado vidas medias en laboratorios para muchos radionucleidos, y pueden variar desde casi instantáneas ( el hidrógeno-5 se desintegra en menos tiempo del que tarda un fotón en ir de un extremo a otro de su núcleo) hasta catorce órdenes de magnitud más largas que la edad del universo : el telurio-128 tiene una vida media de2,2 × 10 24 años .

La ecuación de Bateman predice las cantidades relativas de todos los isótopos que componen una cadena de desintegración dada una vez que dicha cadena ha avanzado lo suficiente como para que algunos de sus productos hijos hayan alcanzado el extremo estable (es decir, no radiactivo) de la cadena. Una cadena de desintegración que ha alcanzado este estado, que puede requerir miles de millones de años, se dice que está en equilibrio . Una muestra de material radiactivo en equilibrio produce una cantidad constante y decreciente de radiactividad a medida que los isótopos que la componen atraviesan la cadena de desintegración. Por otro lado, si una muestra de material radiactivo se ha enriquecido isotópicamente, lo que significa que un radioisótopo está presente en cantidades mayores de las que existirían si una cadena de desintegración fuera la única causa de su presencia, se dice que esa muestra está fuera de equilibrio . Una consecuencia poco intuitiva de este desequilibrio es que una muestra de material enriquecido puede ocasionalmente aumentar en radiactividad a medida que se acumulan productos hijos que son más altamente radiactivos que sus progenitores. Tanto el uranio enriquecido como el empobrecido proporcionan ejemplos de este fenómeno.
Los elementos químicos surgieron en dos fases. La primera comenzó poco después del Big Bang . Entre diez segundos y veinte minutos después del comienzo del universo, la primera condensación de átomos ligeros fue responsable de la fabricación de los cuatro elementos más ligeros. La gran mayoría de esta producción primordial consistió en los tres isótopos más ligeros del hidrógeno ( protio , deuterio y tritio ) y dos de los nueve isótopos conocidos del helio ( helio-3 y helio-4) . Probablemente también se produjeron cantidades traza de litio-7 y berilio-7 .
Hasta donde se sabe, todos los elementos más pesados comenzaron a existir alrededor de 100 millones de años después, en una segunda fase de nucleosíntesis que comenzó con el nacimiento de las primeras estrellas . [1] Los hornos nucleares que impulsan la evolución estelar fueron necesarios para crear grandes cantidades de todos los elementos más pesados que el helio, y se cree que los procesos r y s de captura de neutrones que ocurren en los núcleos estelares crearon todos esos elementos hasta el hierro y el níquel (números atómicos 26 y 28). Las condiciones extremas que acompañan a las explosiones de supernovas son capaces de crear los elementos entre el oxígeno y el rubidio (es decir, números atómicos del 8 al 37). La creación de elementos más pesados, incluidos aquellos sin isótopos estables (todos los elementos con números atómicos mayores que el plomo, 82) parece depender de la nucleosíntesis del proceso r que opera en medio de las inmensas concentraciones de neutrones libres liberados durante las fusiones de estrellas de neutrones .
La mayoría de los isótopos de cada elemento químico presente en la Tierra hoy en día se formaron mediante tales procesos no más tarde del momento de la condensación de nuestro planeta a partir del disco protoplanetario solar , hace unos 4.500 millones de años. Las excepciones a estos llamados elementos primordiales son aquellos que han resultado de la desintegración radiactiva de núcleos parentales inestables a medida que progresan a través de una de varias cadenas de desintegración, cada una de las cuales termina con la producción de uno de los 251 isótopos estables que se sabe que existen. Aparte de la nucleosíntesis cósmica o estelar y las cadenas de desintegración, las únicas otras formas de producir un elemento químico dependen de las armas atómicas , los reactores nucleares ( naturales o artificiales ) o el laborioso ensamblaje átomo por átomo de los núcleos con aceleradores de partículas .
Los isótopos inestables se desintegran en sus productos hijos (que a veces pueden ser incluso más inestables) a una velocidad dada; finalmente, a menudo después de una serie de desintegraciones, se alcanza un isótopo estable: hay 251 isótopos estables en el universo. En los isótopos estables, los elementos ligeros suelen tener una menor proporción de neutrones a protones en su núcleo que los elementos más pesados. Los elementos ligeros como el helio-4 tienen una proporción neutrón:protón cercana a 1:1. Los elementos más pesados como el uranio tienen cerca de 1,5 neutrones por protón (por ejemplo, 1,587 en el uranio-238 ). Ningún nucleido más pesado que el plomo-208 es estable; estos elementos más pesados tienen que desprenderse de masa para lograr la estabilidad, principalmente por desintegración alfa . La otra forma común de desintegración de los isótopos con una alta relación neutrón-protón (n/p) es la desintegración beta , en la que el nucleido cambia de identidad elemental manteniendo el mismo número másico y reduciendo su relación n/p. Para algunos isótopos con una relación n/p relativamente baja, existe una desintegración beta inversa , por la que un protón se transforma en un neutrón, avanzando así hacia un isótopo estable; sin embargo, dado que la fisión casi siempre produce productos que son pesados en neutrones, la emisión de positrones o la captura de electrones son raras en comparación con la emisión de electrones. Hay muchas cadenas de desintegración beta relativamente cortas, al menos dos (una desintegración beta pesada y una desintegración positrónica ligera ) para cada peso discreto hasta alrededor de 207 y algunos más allá, pero para los elementos de mayor masa (isótopos más pesados que el plomo) solo hay cuatro vías que abarcan todas las cadenas de desintegración. [ cita requerida ] Esto se debe a que solo hay dos métodos principales de desintegración: la radiación alfa , que reduce la masa en 4 unidades de masa atómica (uma), y la beta, que no cambia el número másico (solo el número atómico y la relación p/n). Las cuatro rutas se denominan 4n, 4n + 1, 4n + 2 y 4n + 3; el resto de dividir la masa atómica por cuatro da la cadena que utilizará el isótopo para desintegrarse. Hay otros modos de desintegración, pero invariablemente ocurren con una probabilidad menor que la desintegración alfa o beta. (No debe suponerse que estas cadenas no tienen ramificaciones: el diagrama siguiente muestra unas cuantas ramificaciones de cadenas, y en realidad hay muchas más, porque hay muchos más isótopos posibles de los que se muestran en el diagrama.) Por ejemplo, el tercer átomo de nihonium-278 sintetizado experimentó seis desintegraciones alfa hasta mendelevio-254 , [2] seguido de una captura de electrones (una forma de desintegración beta) hasta fermio-254 , [2] y luego una séptima alfa hasta californio-250 , [2]sobre la que se habría seguido la cadena 4n + 2 (serie del radio) como se da en este artículo. Sin embargo, los nucleidos superpesados más pesados sintetizados no alcanzan las cuatro cadenas de desintegración, porque alcanzan un nucleido que se fisiona espontáneamente después de unas pocas desintegraciones alfa que terminan la cadena: esto es lo que sucedió con los dos primeros átomos de nihonium-278 sintetizados, [3] [4] así como con todos los nucleidos más pesados producidos.
Tres de esas cadenas tienen un isótopo (o nucleido) de larga duración cerca de la parte superior; este nucleido de larga duración es un cuello de botella en el proceso a través del cual la cadena fluye muy lentamente, y mantiene "viva" con el flujo a la cadena que está debajo de ellos. Los tres nucleidos de larga duración son el uranio-238 (vida media de 4.500 millones de años), el uranio-235 (vida media de 700 millones de años) y el torio-232 (vida media de 14.000 millones de años). La cuarta cadena no tiene un nucleido de cuello de botella de larga duración cerca de la parte superior, por lo que casi todos los nucleidos de esa cadena se han desintegrado hace mucho tiempo hasta justo antes del final: el bismuto-209. Durante mucho tiempo se pensó que este nucleido era estable, pero en 2003 se descubrió que era inestable, con una vida media muy larga de 20.100 millones de billones de años; [5] es el último paso en la cadena antes del talio-205 estable. Debido a que este cuello de botella es tan duradero, se han producido cantidades muy pequeñas del producto de desintegración final, y para la mayoría de los propósitos prácticos, el bismuto-209 es el producto de desintegración final.
En el pasado lejano, durante los primeros millones de años de la historia del Sistema Solar, existían más tipos de nucleidos inestables de alta masa, y las cuatro cadenas eran más largas, ya que incluían nucleidos que desde entonces se han desintegrado. Cabe destacar que el 244 Pu, el 237 Np y el 247 Cm tienen vidas medias superiores a un millón de años y habrían sido entonces cuellos de botella menores en las cadenas 4n, 4n+1 y 4n+3 respectivamente. [6] (No hay ningún nucleido con una vida media superior a un millón de años por encima del 238 U en la cadena 4n+2). Hoy en día, algunos de estos isótopos anteriormente extintos vuelven a existir tal como se han fabricado. Por lo tanto, vuelven a ocupar su lugar en la cadena: el plutonio-239, utilizado en armas nucleares, es el principal ejemplo, que se desintegra en uranio-235 mediante emisión alfa con una vida media de 24.500 años. También se ha producido a gran escala neptunio-237, que ha resucitado la hasta ahora extinta cuarta cadena. [7] Las tablas siguientes inician las cuatro cadenas de desintegración en isótopos de californio con números de masa de 249 a 252.
Estas cuatro cadenas se resumen en el gráfico de la siguiente sección.

Los cuatro modos más comunes de desintegración radiactiva son: desintegración alfa, desintegración beta, desintegración beta inversa (considerada tanto como emisión de positrones como captura de electrones) y transición isomérica . De estos procesos de desintegración, solo la desintegración alfa (fisión de un núcleo de helio-4 ) cambia el número de masa atómica ( A ) del núcleo, y siempre lo disminuye en cuatro. Debido a esto, casi cualquier desintegración dará como resultado un núcleo cuyo número de masa atómica tiene el mismo residuo módulo 4. Esto divide la lista de nucleidos en cuatro clases. Todos los miembros de cualquier posible cadena de desintegración deben extraerse completamente de una de estas clases.
En la naturaleza se observan tres cadenas (o familias) de desintegración principales, comúnmente llamadas serie del torio, serie del radio o uranio y serie del actinio , que representan tres de estas cuatro clases y terminan en tres isótopos diferentes y estables del plomo . El número de masa de cada isótopo en estas cadenas se puede representar como A = 4 n , A = 4 n + 2 y A = 4 n + 3, respectivamente. Los isótopos iniciales de larga vida de estos tres isótopos, respectivamente torio-232 , uranio-238 y uranio-235 , han existido desde la formación de la Tierra, ignorando los isótopos artificiales y sus desintegraciones creadas desde la década de 1940.
Debido a la vida media relativamente corta de su isótopo inicial, el neptunio-237 (2,14 millones de años), la cuarta cadena, la serie del neptunio con A = 4 n + 1, ya está extinta en la naturaleza, excepto por el paso final que limita la velocidad, la desintegración del bismuto-209 . Sin embargo, en la naturaleza se encuentran trazas de 237 Np y sus productos de desintegración como resultado de la captura de neutrones en el mineral de uranio. [8] Ahora se sabe que el isótopo final de esta cadena es el talio-205 . Algunas fuentes más antiguas dan como isótopo final el bismuto-209, pero en 2003 se descubrió que es muy ligeramente radiactivo, con una vida media de2,01 × 10 19 años . [9]
También existen cadenas de desintegración no transuránicas de isótopos inestables de elementos ligeros, por ejemplo, los de magnesio-28 y cloro-39 . En la Tierra, la mayoría de los isótopos iniciales de estas cadenas antes de 1945 fueron generados por radiación cósmica . Desde 1945, las pruebas y el uso de armas nucleares también han liberado numerosos productos de fisión radiactivos . Casi todos estos isótopos se desintegran mediante modos de desintegración β − o β + , cambiando de un elemento a otro sin cambiar la masa atómica. Estos productos secundarios posteriores, al estar más cerca de la estabilidad, generalmente tienen vidas medias más largas hasta que finalmente se desintegran en la estabilidad.
En las cuatro tablas que aparecen a continuación, se omiten las ramas menores de la desintegración (con una probabilidad de ramificación inferior al 0,0001%). La liberación de energía incluye la energía cinética total de todas las partículas emitidas ( electrones , partículas alfa , gamma quanta , neutrinos , electrones Auger y rayos X ) y el núcleo de retroceso, suponiendo que el núcleo original estaba en reposo. La letra "a" representa un año (del latín annus ).
En las tablas que aparecen a continuación (excepto el neptunio) también se dan los nombres históricos de los nucleidos naturales. Estos nombres se utilizaban en la época en que se descubrieron e investigaron por primera vez las cadenas de desintegración. A partir de estos nombres históricos se puede localizar la cadena concreta a la que pertenece el nucleido y sustituirla por su nombre moderno.
Las tres cadenas de desintegración alfa de actínidos naturales que se indican a continuación (torio, uranio/radio (a partir del uranio-238) y actinio (a partir del uranio-235)) terminan cada una con su propio isótopo de plomo específico (plomo-208, plomo-206 y plomo-207 respectivamente). Todos estos isótopos son estables y también están presentes en la naturaleza como nucleidos primordiales , pero sus cantidades excedentes en comparación con el plomo-204 (que solo tiene un origen primordial) se pueden utilizar en la técnica de datación uranio-plomo para datar rocas.
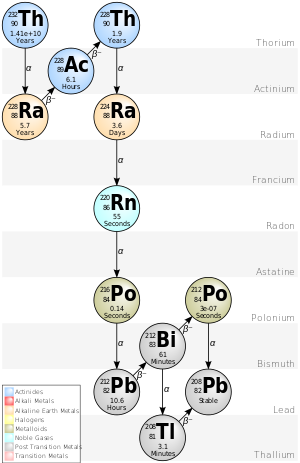
La cadena 4n del torio-232 se denomina comúnmente "serie del torio" o "cascada del torio". Esta serie, que comienza con el torio-232 de origen natural, incluye los siguientes elementos: actinio , bismuto , plomo, polonio , radio, radón y talio . Todos ellos están presentes, al menos de forma transitoria, en cualquier muestra natural que contenga torio, ya sea metal, compuesto o mineral. La serie termina con el plomo-208.
El plutonio-244 (que aparece varios pasos por encima del torio-232 en esta cadena si se la extiende a los transuránicos) estaba presente en el Sistema Solar primitivo, [6] y tiene una vida lo suficientemente larga como para que aún sobreviva en cantidades traza hoy en día, [15] aunque no se sabe con certeza si ha sido detectado. [16]
La energía total liberada del torio-232 al plomo-208, incluida la energía perdida por los neutrinos, es de 42,6 MeV.
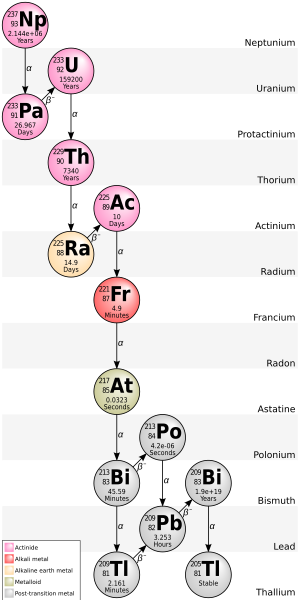
La cadena 4n + 1 del neptunio-237 se denomina comúnmente "serie del neptunio" o "cascada del neptunio". En esta serie, solo dos de los isótopos involucrados se encuentran de forma natural en cantidades significativas, a saber, los dos últimos: bismuto-209 y talio-205. Algunos de los otros isótopos se han detectado en la naturaleza, originados a partir de trazas de 237 Np producidas por la reacción de eliminación (n,2n) en el 238 U primordial. [8] Un detector de humo que contiene una cámara de ionización de americio-241 acumula una cantidad significativa de neptunio -237 a medida que su americio se desintegra. Los siguientes elementos también están presentes en él, al menos transitoriamente, como productos de desintegración del neptunio: actinio, astato , bismuto, francio , plomo, polonio, protactinio , radio, radón, talio, torio y uranio . Dado que esta serie se descubrió y estudió recién en 1947-1948, [21] sus nucleidos no tienen nombres históricos. Una característica única de esta cadena de desintegración es que el gas noble radón solo se produce en una rama poco frecuente (no se muestra en la ilustración), pero no en la secuencia de desintegración principal; por lo tanto, el radón de esta cadena de desintegración no migra a través de la roca tanto como el de las otras tres. Otra característica única de esta secuencia de desintegración es que termina en talio (prácticamente hablando, bismuto) en lugar de plomo. Esta serie termina con el isótopo estable talio-205.
La energía total liberada del californio-249 al talio-205, incluida la energía perdida por los neutrinos , es de 66,8 MeV.
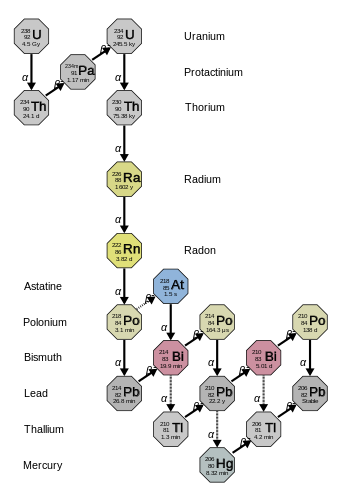
La cadena 4n+2 del uranio-238 se denomina "serie del uranio" o "serie del radio". Esta serie, que comienza con el uranio-238 de origen natural, incluye los siguientes elementos: astato, bismuto, plomo , mercurio , polonio, protactinio , radio , radón , talio y torio. Todos ellos están presentes, al menos de forma transitoria, en cualquier muestra que contenga uranio natural, ya sea metal, compuesto o mineral. La serie termina con el plomo-206.
La energía total liberada del uranio-238 al plomo-206, incluida la energía perdida por los neutrinos, es de 51,7 MeV.
La cadena 4n+3 del uranio-235 se denomina comúnmente "serie del actinio" o "cascada del actinio". Esta serie de desintegración, que comienza con el isótopo natural uranio-235, incluye los siguientes elementos: actinio, astato , bismuto , francio , plomo , polonio , protactinio , radio, radón, talio y torio . Todos ellos están presentes, al menos de forma transitoria, en cualquier muestra que contenga uranio-235, ya sea metal, compuesto, mena o mineral. Esta serie termina con el isótopo estable plomo-207 .

En el Sistema Solar primitivo, esta cadena se remontaba a 247 Cm. Esto se manifiesta hoy en día como variaciones en las proporciones 235 U/ 238 U, ya que el curio y el uranio tienen químicas notablemente diferentes y se habrían separado de manera diferente. [6] [24]
La energía total liberada del uranio-235 al plomo-207, incluida la energía perdida por los neutrinos, es de 46,4 MeV.
{{cite web}}: CS1 maint: multiple names: authors list (link)