La difuncionalización vecinal se refiere a una reacción química que involucra transformaciones en dos centros adyacentes (más comúnmente carbonos). Esta transformación se puede lograr en compuestos carbonílicos α,β-insaturados mediante la adición conjugada de un nucleófilo a la posición β seguida de la captura del enolato resultante con un electrófilo en la posición α. Cuando el nucleófilo es un enolato y el electrófilo un protón , la reacción se llama adición de Michael . [1]
Las reacciones de difuncionalización vecinal, en general, conducen a nuevos enlaces en dos átomos de carbono adyacentes. A menudo esto ocurre de forma estereocontrolada, especialmente si ambos enlaces se forman simultáneamente, como en la reacción de Diels-Alder . Los dobles enlaces activados representan una herramienta útil para la difuncionalización vecinal porque pueden actuar como nucleófilos y electrófilos : un carbono es necesariamente pobre en electrones y el otro rico en electrones. Entonces, en presencia de un nucleófilo y un electrófilo, los dos carbonos de un doble enlace pueden actuar como un "relé", mediando el flujo de electrones del nucleófilo al electrófilo con la formación de dos enlaces químicos, en lugar del habitual. .
(1)
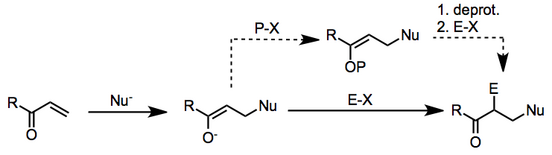
Muy a menudo, el nucleófilo empleado en este contexto es un compuesto organometálico y el electrófilo es un haluro de alquilo .
El mecanismo se desarrolla en dos etapas: adición β-nucleofílica al compuesto carbonílico insaturado, seguida de sustitución electrófila en el carbono α del enolato resultante .
Cuando el nucleófilo es un reactivo organometálico, los mecanismos del primer paso pueden variar. En algunos casos no está claro si las reacciones tienen lugar mediante mecanismos iónicos o radicales. [2] Las investigaciones han demostrado que el segundo paso puede incluso realizarse mediante transferencias de un solo electrón cuando el potencial de reducción del electrófilo es bajo. [3] A continuación se muestra un esquema general que involucra intermediarios iónicos.
(2)
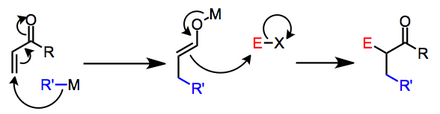
Los organocupratos de litio se someten a una adición oxidativa a las enonas para dar, después de la eliminación reductora de una especie de organocobre (III), enolatos de litio β-sustituidos. [4]
En cualquier caso, el segundo paso está bien descrito en todos los casos como la reacción de un enolato con un electrófilo. Las dos etapas pueden llevarse a cabo como operaciones experimentales distintas si el enolato inicialmente formado se protege después de la β-adición. Sin embargo, si los dos pasos no son distintos, el contraión del enolato está determinado por el contraión del material de partida nucleófilo y puede influir profundamente en la reactividad del enolato.
El control de aproximación estérica es común en reacciones de adición conjugada. Por tanto, en sustratos cíclicos, es común una relación trans entre sustituyentes en los carbonos α y β. La configuración en la posición α es menos predecible, especialmente en los casos en que puede ocurrir epimerización. Sobre la base del control de aproximación estérica, se predice que el nuevo sustituyente α será trans con respecto al nuevo sustituyente β, y esto se observa en varios casos. [5]
(3)
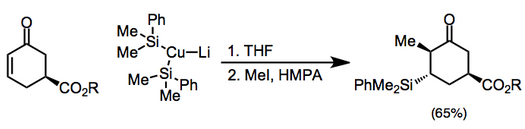
Los reactivos de organocobre son los nucleófilos más comunes para el paso de adición β. Estos reactivos se pueden generar catalíticamente en presencia de reactivos de Grignard utilizando sales de cobre (I) o de cobre (II). [6]
(4)
Los reactivos de cobre también se pueden utilizar estequiométricamente y, entre ellos, los organocupratos son los más comunes (son más reactivos que los correspondientes compuestos organocobre(I) neutros). El contraión cuprato puede afectar la adición y la posterior reacción del enolato de manera sutil. [7] Las adiciones que involucran cupratos de orden superior deben apagarse con un haluro de sililo antes de la alquilación. [8](5)
Cuando se emplean cupratos asimétricos, el grupo cuyo enlace carbono-cobre contiene menos carácter s casi siempre se transfiere a la posición β. Sin embargo, existen algunas excepciones. [9] En el siguiente ejemplo, realizar la reacción en THF condujo a la transferencia del resto vinilo, mientras que otros disolventes promovieron la transferencia de metilo.
(6)
Los enolatos también se pueden utilizar como nucleófilos para reacciones de difuncionalización vecinales. Para evitar la simple adición de Michael (que culmina en la protonación del enolato intermedio), el atrapamiento por parte del electrófilo debe ser intramolecular. [10]
(7)
Las consideraciones del electrófilo deben tener en cuenta la naturaleza del enolato conjugado generado después del primer paso. Se deben utilizar agentes alquilantes relativamente reactivos, especialmente en casos que implican la adición de cupratos (los enolatos resultantes de la adición de cupratos a menudo no reaccionan). Si se desea la alquilación C, se deben evitar los electrófilos oxófilos. Los electrófilos también deberían carecer de hidrógenos lo suficientemente ácidos como para ser desprotonados por un enolato.
Las cetonas cíclicas α,β-insaturadas son los sustratos más comúnmente empleados para la difuncionalización vecinal. Tienden a ser más reactivos que los análogos acíclicos y sufren una adición menos directa que los aldehídos. Se pueden utilizar amidas y ésteres para fomentar la adición de conjugados en los casos en que la adición directa puede ser competitiva (como en la adición de compuestos de organolitio). [11]
(8)
Debido a que el paso de adición es muy sensible a los efectos estéricos, es probable que los sustituyentes β ralenticen la reacción. Los sustratos acetilénicos y alénicos reaccionan para dar productos con cierta insaturación retenida. [12] [13]
(9)
En la literatura existe una gran cantidad de ejemplos de difuncionalización vecinal de compuestos carbonílicos insaturados. En un ejemplo, se empleó la difuncionalización de la lactona insaturada 1 en el camino hacia isostegano. Esta transformación se logró en una sola olla. [14]
(10)
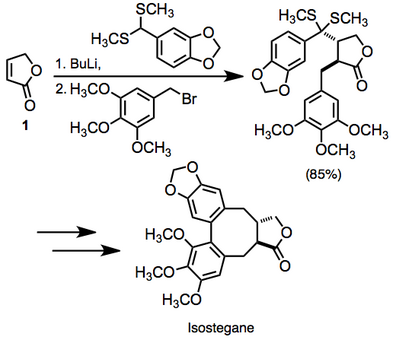
Debido a que la reacción crea dos nuevos enlaces con un grado moderadamente alto de estereocontrol, representa un método sintético altamente convergente.
Los nucleófilos organometálicos utilizados para adiciones de conjugados se preparan con mayor frecuencia in situ . Es necesario el uso de equipos anhidros y atmósfera inerte. Debido a que estos factores a veces son difíciles de controlar y la concentración de los reactivos recién preparados puede variar sustancialmente, son necesarios métodos de titulación para verificar la pureza de los reactivos. Existen varias metodologías de titulación eficientes. [15]
Habitualmente las difuncionalizaciones vecinales se realizan en un solo recipiente, sin la intermediación de un enolato neutro protegido. Sin embargo, en casos específicos puede ser necesario proteger el intermediario de la β-adición. Sin embargo, antes de llegar a este punto, se pueden realizar análisis de disolventes y nucleófilos, ajustes del orden de adición y ajustes de contraiones para optimizar el proceso en un solo recipiente para una combinación particular de compuesto carbonílico, nucleófilo y agente alquilante (o acilante). Los ajustes de solvente entre los dos pasos son comunes; si se utiliza un disolvente, el tetrahidrofurano es el disolvente de elección. Se deben evitar los disolventes apróticos polares en el paso de adición del conjugado. En cuanto a la temperatura, las adiciones de conjugados se suelen realizar a bajas temperaturas (-78 °C), mientras que las alquilaciones se llevan a cabo a temperaturas ligeramente más altas (0 a -30 °C). Los agentes alquilantes menos reactivos pueden requerir temperatura ambiente.
(11)
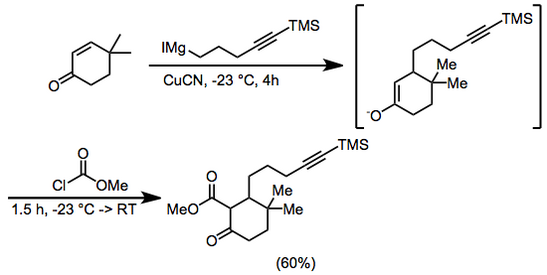
A 6,25 g (50 mmol) de 4,4-dimetil-2-ciclohexen-1-ona y 0,5 g (5,6 mmol) de cianuro cuproso en 400 ml de éter dietílico a –23° bajo argón se añadieron 100 ml (~0,75 M en éter dietílico) de yoduro de 5-trimetilsilil-4-pentinilmagnesio durante 4 horas. Se añadió cloroformiato de metilo (8 ml, 100 mmol) y se continuó agitando durante 1 hora a –23°C y 0,5 horas a temperatura ambiente. Luego se añadió ácido clorhídrico (100 ml, 2,0 M) y la fase orgánica se separó y se secó con sulfato de magnesio . Se eliminó el disolvente y el residuo se cromatografió en gel de sílice usando éter dietílico al 5% - éter de petróleo para dar 3,3-dimetil-6-oxo-2-[5-(trimetilsilil)-4-pentinilo]ciclohexanocarboxilato de metilo, 9,66 g ( 60%). IR 2000, 2140, 1755, 1715, 1660, 1615, 1440, 1280, 1250, 1225, 1205 y 845 cm–1; RMN 1H (CDCl3 ) δ 0,13 (s, 9H), 0,93 (s, 3H), 1,02 (s, 3H), 1,2–2,3 (m, 11H), 3,74 (s, 3H). Anal. Calc. para C18H30O3Si : C , 67,05 ; H, 9,4. Encontrado: C, 67,1; Alto, 9,65.