Un micrótomo (del griego mikros , que significa "pequeño", y temnein , que significa "cortar") es una herramienta de corte que se utiliza para producir cortes extremadamente finos de material, conocidos como secciones , y el proceso se denomina microseccionamiento . Los micrótomos, importantes en la ciencia , se utilizan en microscopía para la preparación de muestras para su observación bajo luz transmitida o radiación electrónica .
Los micrótomos utilizan hojas de acero , vidrio o diamante , según la muestra que se esté cortando y el grosor deseado de las secciones que se estén cortando. Las hojas de acero se utilizan para preparar secciones histológicas de tejidos animales o vegetales para microscopía óptica . Los cuchillos de vidrio se utilizan para cortar secciones para microscopía óptica y para cortar secciones muy delgadas para microscopía electrónica . Los cuchillos de diamante de grado industrial se utilizan para cortar materiales duros como huesos , dientes y materia vegetal resistente, tanto para microscopía óptica como para microscopía electrónica. Los cuchillos de diamante de calidad gema también se utilizan para cortar secciones delgadas para microscopía electrónica.
La microtomía es un método para la preparación de secciones delgadas de materiales como huesos, minerales y dientes, y una alternativa al electropulido y al fresado iónico . Las secciones del micrótomo pueden hacerse lo suficientemente delgadas como para seccionar un cabello humano a lo ancho, con un espesor de sección de entre 50 nm y 100 μm .

En los inicios del desarrollo de los microscopios ópticos , las secciones de plantas y animales se preparaban manualmente utilizando hojas de afeitar. Se descubrió que para observar la estructura de la muestra en observación era importante realizar cortes limpios y reproducibles del orden de 100 μm, a través de los cuales se puede transmitir la luz. Esto permitió la observación de muestras utilizando microscopios ópticos en modo de transmisión.
Uno de los primeros dispositivos para la preparación de tales cortes fue inventado en 1770 por George Adams, Jr. (1750-1795) y desarrollado posteriormente por Alexander Cummings . [2] El dispositivo se operaba manualmente y la muestra se sostenía en un cilindro y se creaban secciones desde la parte superior de la muestra utilizando una manivela. [1] [3]
En 1835, Andrew Prichard desarrolló un modelo basado en una mesa que permitía aislar la vibración fijando el dispositivo a la mesa, separando al operador del cuchillo. [4]
En ocasiones, se atribuye la invención del micrótomo al anatomista Wilhelm His, Sr. (1865). [5] [6] En su Beschreibung eines Mikrotoms ( Descripción de un micrótomo en alemán ), Wilhelm escribió:
El aparato me ha permitido trabajar con una precisión tal que puedo lograr cortes que no podría crear a mano, es decir, me ha permitido lograr cortes completos de objetos durante la investigación.
Otras fuentes atribuyen además el desarrollo al fisiólogo checo Jan Evangelista Purkyně . [7] Varias fuentes describen el modelo de Purkyně como el primero en uso práctico. [8] [9]
Las oscuridades en los orígenes del micrótomo se deben al hecho de que los primeros micrótomos eran simplemente aparatos de corte y la fase de desarrollo de los primeros dispositivos está ampliamente indocumentada.
A finales del siglo XIX, el desarrollo de muestras muy delgadas y consistentemente delgadas mediante microtomía, junto con la tinción selectiva de componentes celulares o moléculas importantes, permitió la visualización de detalles en el microscopio. [10] [11]
En la actualidad, la mayoría de los micrótomos tienen un diseño de bloque de cuchillas con una cuchilla intercambiable, un portamuestras y un mecanismo de avance. En la mayoría de los dispositivos, el corte de la muestra comienza al mover la muestra sobre la cuchilla, donde el mecanismo de avance avanza automáticamente de modo que se pueda realizar el siguiente corte para un espesor elegido. El espesor de la sección se controla mediante un mecanismo de ajuste, lo que permite un control preciso.

Las aplicaciones más comunes de los micrótomos son:
Un desarrollo reciente es el micrótomo láser , que corta la muestra de destino con un láser de femtosegundo en lugar de un cuchillo mecánico. Este método no requiere contacto y no requiere técnicas de preparación de la muestra. El micrótomo láser tiene la capacidad de cortar casi cualquier tejido en su estado original. Dependiendo del material que se esté procesando, se pueden alcanzar espesores de corte de 10 a 100 μm.
Los intervalos de seccionamiento se pueden clasificar principalmente en:
Los cortes de riñón cortados con precisión son secciones delgadas del tejido renal que se preparan con un micrótomo para estudiar las funciones renales, el metabolismo de fármacos o los procesos patológicos. Los investigadores utilizan estos cortes para estudiar el impacto de las sustancias en la función renal. [13] [14] Esto incluye el metabolismo de fármacos [15] [16] y los efectos de las sustancias tóxicas. [17]

Un micrótomo de trineo es un dispositivo en el que la muestra se coloca en un soporte fijo (lanzadera), que luego se mueve hacia atrás y hacia adelante a través de una cuchilla. Los micrótomos de trineo modernos tienen el trineo colocado sobre un cojinete lineal, un diseño que permite que el micrótomo corte fácilmente muchas secciones gruesas. [18] Al ajustar los ángulos entre la muestra y la cuchilla del micrótomo, se puede reducir la presión aplicada a la muestra durante el corte. [18] Las aplicaciones típicas para este diseño de micrótomo son la preparación de muestras grandes, como las embebidas en parafina para preparaciones biológicas. El espesor de corte típico que se puede lograr en un micrótomo de trineo es de entre 1 y 60 μm.

Este instrumento es un diseño de micrótomo común. Este dispositivo funciona con una acción rotatoria escalonada de modo que el corte real es parte del movimiento rotatorio. En un micrótomo rotatorio, la cuchilla normalmente está fija en posición vertical. [19]
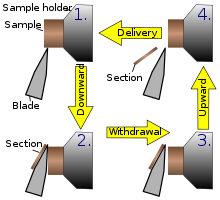
En la figura de la izquierda se explica el principio del corte. Mediante el movimiento del portamuestras, la muestra se corta con la cuchilla de la posición 1 a la posición 2, momento en el que la sección fresca permanece en la cuchilla. En el punto más alto del movimiento giratorio, el portamuestras avanza el mismo grosor que la sección que se va a realizar, lo que permite realizar la siguiente sección.
El volante de inercia de muchos micrótomos se puede accionar manualmente. Esto tiene la ventaja de que se puede realizar un corte limpio, ya que la masa relativamente grande del volante de inercia evita que la muestra se detenga durante el corte de la misma. El volante de inercia de los modelos más nuevos suele estar integrado dentro de la carcasa del micrótomo. El grosor de corte típico de un micrótomo rotatorio es de entre 1 y 60 μm. Para materiales duros, como una muestra embebida en una resina sintética, este diseño de micrótomo puede permitir cortes "semidelgados" de buena calidad con un grosor de tan solo 0,5 μm.

Para el corte de muestras congeladas, muchos micrótomos rotatorios se pueden adaptar para cortar en una cámara de nitrógeno líquido, en una configuración denominada criomicrotomo. La temperatura reducida permite aumentar la dureza de la muestra, por ejemplo, sometiéndola a una transición vítrea, lo que permite la preparación de muestras semidelgadas. [18] Sin embargo, la temperatura de la muestra y la temperatura de la cuchilla deben controlarse para optimizar el espesor de la muestra resultante.

El ultramicrotomo es una herramienta fundamental en la ultramicrotomía . Permite la preparación de secciones extremadamente delgadas, ya que el dispositivo funciona de la misma manera que un micrótomo rotatorio, pero con tolerancias muy estrictas en la construcción mecánica. Como resultado de la cuidadosa construcción mecánica, la expansión térmica lineal del soporte se utiliza para proporcionar un control muy preciso del espesor. [18]
Estos cortes extremadamente finos son importantes para su uso con microscopios electrónicos de transmisión (TEM) y microscopía electrónica de barrido de caras de bloque en serie (SBFSEM), y a veces también son importantes para la microscopía óptica de luz. [19] El espesor típico de estos cortes es de entre 40 y 100 nm para microscopía electrónica de transmisión y, a menudo, de entre 30 y 50 nm para SBFSEM. También se toman secciones más gruesas de hasta 500 nm de espesor para aplicaciones TEM especializadas o para secciones de estudio de microscopía de luz para seleccionar un área para las secciones delgadas finales. Se utilizan cuchillas de diamante (preferiblemente) y cuchillas de vidrio con ultramicrótomos. Para recolectar las secciones, se las deja flotar sobre un líquido a medida que se cortan y se las recoge con cuidado en rejillas adecuadas para la visualización de muestras TEM. El espesor de la sección se puede estimar por los colores de interferencia de película delgada de la luz reflejada que se ven como resultado del espesor extremadamente bajo de la muestra. [20]
El micrótomo vibratorio funciona cortando con una cuchilla vibratoria, lo que permite realizar el corte resultante con menos presión que la que se requeriría con una cuchilla estacionaria. El micrótomo vibratorio se utiliza generalmente para muestras biológicas difíciles. [18] El espesor de corte suele rondar los 30–500 μm para tejido vivo y los 10–500 μm para tejido fijo. [21]
El micrótomo de sierra está especialmente diseñado para materiales duros como dientes o huesos. El micrótomo de este tipo tiene una sierra giratoria empotrada que corta la muestra. El espesor mínimo de corte es de aproximadamente 30 μm y se puede utilizar para muestras relativamente grandes. [18]
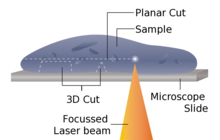
El micrótomo láser es un instrumento para realizar cortes sin contacto. [22] No se requiere una preparación previa de la muestra mediante incrustación, congelación o fijación química , lo que minimiza los artefactos de los métodos de preparación. Alternativamente, este diseño de micrótomo también se puede utilizar para materiales muy duros, como huesos o dientes, así como algunas cerámicas. Dependiendo de las propiedades del material de la muestra, el espesor alcanzable está entre 10 y 100 μm.
El dispositivo funciona mediante la acción de corte de un láser infrarrojo. Como el láser emite una radiación en el infrarrojo cercano, en este régimen de longitud de onda el láser puede interactuar con materiales biológicos. Mediante el enfoque preciso de la sonda dentro de la muestra, se puede lograr un punto focal de intensidad muy alta, hasta TW /cm2 . A través de la interacción no lineal de la penetración óptica en la región focal se introduce una separación de material en un proceso conocido como fotodisrupción. Al limitar las duraciones del pulso láser al rango de femtosegundos, la energía gastada en la región objetivo se controla con precisión, limitando así la zona de interacción del corte a menos de un micrómetro. Fuera de esta zona, el tiempo de aplicación del haz ultracorto introduce un daño térmico mínimo o nulo en el resto de la muestra.
La radiación láser se dirige a un sistema óptico basado en un espejo de escaneo rápido, que permite el posicionamiento tridimensional del cruce del haz, al mismo tiempo que permite el recorrido del haz hasta la región de interés deseada. La combinación de alta potencia con una alta velocidad de barrido permite al escáner cortar grandes áreas de muestra en poco tiempo. En el micrótomo láser también es posible la microdisección láser de áreas internas en tejidos, estructuras celulares y otros tipos de características pequeñas.


La selección del perfil de la hoja de la cuchilla del micrótomo depende del material y la preparación de las muestras, así como de los requisitos finales de la muestra (por ejemplo, espesor y calidad del corte).

Generalmente, los cuchillos se caracterizan por el perfil de la hoja, que se clasifica dentro de las categorías de diseños cóncavos planos, en forma de cuña o en forma de cincel.
Las cuchillas de micrótomo cóncavas planas son extremadamente afiladas, pero también muy delicadas y, por lo tanto, solo se utilizan con muestras muy blandas. [19] Las cuchillas de perfil de cuña son algo más estables y se utilizan en materiales moderadamente duros, como en el corte de muestras criogénicas o de epoxi. Finalmente, el perfil de cincel con su borde romo aumenta la estabilidad de la cuchilla, aunque requiere mucha más fuerza para lograr el corte.
Para los ultramicrotomos se requieren cuchillas de vidrio y diamante, por lo que el ancho de corte de la hoja es del orden de unos pocos milímetros y, por lo tanto, es significativamente menor que el de las cuchillas de micrótomo clásicas. Las cuchillas de vidrio se fabrican generalmente mediante la fractura de barras de vidrio utilizando dispositivos de fractura especiales "fabricantes de cuchillas". Las cuchillas de vidrio se pueden utilizar para las preparaciones iniciales de la muestra, incluso cuando se pueden utilizar cuchillas de diamante para el seccionamiento final. Las cuchillas de vidrio suelen tener pequeños canales, hechos con cinta de plástico, que se llenan de agua para permitir que la muestra flote para su posterior recolección. [18] Las cuchillas de diamante se pueden construir en un canal existente, lo que permite el mismo método de recolección.
Antes de cortar con el micrótomo, los materiales biológicos suelen colocarse en un fijador más rígido, en un proceso conocido como incrustación. Esto se logra mediante la entrada de una sustancia líquida alrededor de la muestra, como parafina (cera) o epoxi, que se coloca en un molde y luego se endurece para producir un "bloque" que se corta fácilmente.
La declinación es el ángulo de contacto entre la vertical de la muestra y la hoja del cuchillo. Si la hoja del cuchillo está en ángulo recto (declinación = 90), el corte se realiza directamente utilizando un modo basado en presión y, por lo tanto, las fuerzas son proporcionalmente mayores. Sin embargo, si el cuchillo está inclinado, el movimiento relativo del cuchillo es cada vez más paralelo al movimiento de la muestra, lo que permite una acción de corte. Este comportamiento es muy importante para muestras grandes o duras.
La inclinación de la cuchilla es el ángulo entre la cara de la cuchilla y la muestra. Para obtener un resultado óptimo, este ángulo debe elegirse adecuadamente. El ángulo óptimo depende de la geometría de la cuchilla, la velocidad de corte y muchos otros parámetros. Si el ángulo se ajusta a cero, el corte de la cuchilla puede volverse errático y se debe utilizar una nueva ubicación de la cuchilla para suavizar este problema.
Si el ángulo es demasiado grande, la muestra puede arrugarse y el cuchillo puede provocar variaciones periódicas de espesor en el corte. Si se aumenta aún más el ángulo hasta que sea demasiado grande, se puede dañar la hoja del cuchillo.