El cloruro de tris(bipiridina)rutenio(II) es el complejo de coordinación de la sal de cloruro con la fórmula [Ru(bpy) 3 ]Cl 2 . Este complejo de polipiridina es una sal cristalina roja obtenida como hexahidrato , aunque todas las propiedades de interés están en el catión [Ru(bpy) 3 ] 2+ , que ha recibido mucha atención debido a sus propiedades ópticas distintivas. Los cloruros se pueden reemplazar con otros aniones , como PF 6 − .

Esta sal se prepara tratando una solución acuosa de tricloruro de rutenio con 2,2'-bipiridina . En esta conversión, el Ru(III) se reduce a Ru(II) y, por lo general, se agrega ácido hipofosforoso como agente reductor. [1] [Ru(bpy) 3 ] 2+ es octaédrico y contiene un ion central Ru(II) d 6 de espín bajo y tres ligandos bpy bidentados. Las distancias Ru-N son 2,053(2), más cortas que las distancias Ru-N para [Ru(bpy) 3 ] 3+ . [2] El complejo es quiral, con simetría D 3 . Se ha resuelto en sus enantiómeros . Se cree que en su estado excitado de triplete más bajo, la molécula alcanza una simetría C 2 más baja , ya que el electrón excitado se localiza principalmente en un solo ligando bipiridilo. [3] [4]
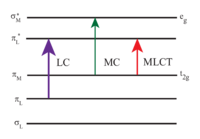
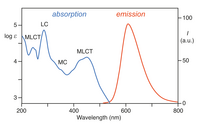
[Ru(bpy) 3 ] 2+ absorbe luz ultravioleta y visible. Las soluciones acuosas de [Ru(bpy) 3 ]Cl 2 son anaranjadas debido a una fuerte absorción MLCT a 452 ± 3 nm ( coeficiente de extinción de 14.600 M −1 cm −1 ). Se encuentran bandas de absorción adicionales a 285 nm correspondientes a transiciones π * ← π centradas en el ligando y una transición débil alrededor de 350 nm (transición dd). [5] La absorción de luz da como resultado la formación de un estado excitado que tiene una vida útil relativamente larga de 890 ns en acetonitrilo [6] y 650 ns en agua. [6] El estado excitado se relaja al estado fundamental por emisión de un fotón o relajación no radiativa. El rendimiento cuántico es del 2,8% en agua saturada de aire a 298 K y la longitud de onda máxima de emisión es de 620 nm. [7] La larga duración de vida del estado excitado se atribuye al hecho de que es triplete , mientras que el estado fundamental es un estado singlete y en parte al hecho de que la estructura de la molécula permite la separación de cargas. Las transiciones singlete-triplete están prohibidas y, por lo tanto, suelen ser lentas .
Al igual que todos los estados excitados moleculares, el estado excitado triplete de [Ru(bpy) 3 ] 2+ tiene propiedades oxidantes y reductoras más fuertes que su estado fundamental. Esta situación surge porque el estado excitado puede describirse como un complejo Ru 3+ que contiene un anión radical bpy •− como ligando. Por lo tanto, las propiedades fotoquímicas de [Ru(bpy) 3 ] 2+ recuerdan al ensamblaje fotosintético , que también implica la separación de un electrón y un hueco . [8]
[Ru(bpy) 3 ] 2+ se ha examinado como un fotosensibilizador tanto para la oxidación como para la reducción del agua. Al absorber un fotón, [Ru(bpy) 3 ] 2+ se convierte al estado triplete mencionado anteriormente, denotado [Ru(bpy) 3 ] 2+ *. Esta especie transfiere un electrón, ubicado en un ligando bpy, a un oxidante sacrificial como el peroxodisulfato (S 2 O 8 2− ). El [Ru(bpy) 3 ] 3+ resultante es un oxidante poderoso y oxida el agua en O 2 y protones a través de un catalizador . [9] Alternativamente, el poder reductor de [Ru(bpy) 3 ] 2+ * se puede aprovechar para reducir el metilviológeno , un portador reciclable de electrones, que a su vez reduce protones en un catalizador de platino . Para que este proceso sea catalítico, se proporciona un reductor de sacrificio, como EDTA 4− o trietanolamina , para devolver el Ru(III) a Ru(II).
Los derivados de [Ru(bpy) 3 ] 2+ son numerosos. [10] [11] Estos complejos se discuten ampliamente para aplicaciones en biodiagnóstico, energía fotovoltaica y diodos orgánicos emisores de luz , pero no se ha comercializado ningún derivado. La aplicación de [Ru(bpy) 3 ] 2+ y sus derivados a la fabricación de sensores químicos ópticos es posiblemente una de las áreas más exitosas hasta el momento. [12]
La catálisis fotorredox utiliza [Ru(bpy) 3 ] 2+ como sensibilizador como estrategia para la síntesis orgánica. También se emplean muchos análogos de [Ru(bpy) 3 ] 2+ . Estas transformaciones explotan las propiedades redox de [Ru(bpy) 3 ] 2+ * y su derivado extinguido reductivamente [Ru(bpy) 3 ] + . [13] [14] [15] [16]
La bipiridina metálica, así como los complejos de fenantrolina relacionados , son generalmente bioactivos, ya que pueden actuar como agentes intercalantes .
{{cite book}}: Mantenimiento de CS1: ubicación ( enlace ){{cite book}}: |journal=ignorado ( ayuda )