El tiostreptón es un antibiótico oligopeptídico cíclico natural de la clase de los tiopéptidos , derivado de varias cepas de estreptomicetos , como Streptomyces azureus y Streptomyces laurentii . El tiostreptón es un producto natural de la clase de péptidos sintetizados ribosomalmente y modificados postraduccionalmente (RiPP).
El tiostreptón fue descubierto por Donovick et al. quien describió sus propiedades antibacterianas en 1955. [3] Dorothy Crowfoot Hodgkin resolvió la estructura del tiostreptón en 1970. [4] A principios de 1978, Bycroft y Gowland [5] propusieron la biosíntesis del tiostreptón, que aún no estaba clara hasta 2009. Varios estudios de la biosíntesis de tiopéptidos [6] [7] [8] [9] se publicaron contemporáneamente en 2009 y dos de ellos (Liao et al. y Kelly et al. ) incluyeron la biosíntesis similar de tiostrepton: se sintetiza ribosomalmente a partir de genes biosintéticos de tiostrepton. (genes tsr) y se necesita una modificación postraduccional. [ cita necesaria ]
KC Nicolaou y col. completaron una síntesis total de tiostreptón . en 2004. [10] [11]
El tiostreptón se ha utilizado en medicina veterinaria en la mastitis causada por organismos gramnegativos y en trastornos dermatológicos. Se utiliza principalmente en ungüentos complejos que contienen neomicina , nistatina , tiostreptón y esteroides tópicos . También es activo contra bacterias grampositivas. Es de destacar que los ungüentos para uso humano contienen neomicina , nistatina y esteroides tópicos , pero no tiostreptón. [ cita necesaria ]
Se informó (en 2008) que el tiostreptón exhibe actividad contra las células de cáncer de mama al atacar el factor de transcripción forkhead box M1 ( FOXM1 ), [12] también en 2011. [13] También se ha demostrado que evita la resistencia adquirida al cisplatino en las células de cáncer de mama. en condiciones in vitro . [14]
El tiostreptón se utiliza en biología molecular como reactivo para la selección positiva y negativa de genes implicados en el metabolismo de los nucleótidos. [ cita necesaria ]
El tiostreptón también se ha mostrado prometedor en el tratamiento de la osteoporosis en modelos animales porque puede inhibir células precursoras de osteoclastos inusuales. [15]
El antibiótico tiostreptón fue identificado como un agente para revertir la resistencia a la insulina . La validación posterior en músculo de ratón resistente a la insulina ex vivo y en miotubos resistentes a la insulina inducidos por palmitato demostró una potente restauración de la acción de la insulina, posiblemente a través de la regulación positiva de la glucólisis debido a la atenuación de la fosforilación oxidativa mitocondrial por el tiostreptón. [dieciséis]
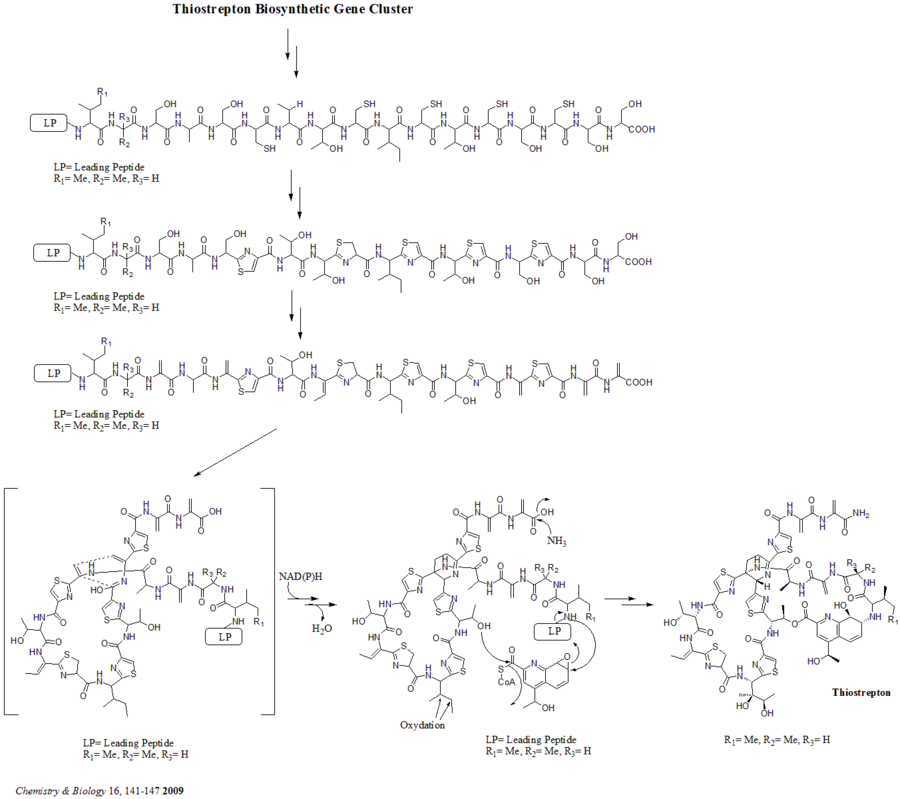
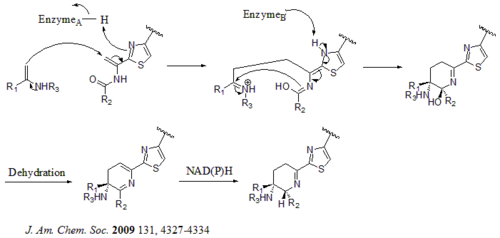
Hay un total de 21 genes (tsrA ~ tsrU) en el grupo de genes biosintéticos. El precursor del tiostreptón contiene 58 aminoácidos en la cadena peptídica, que incluye el péptido líder de 41 aminoácidos (LP) y el péptido estructural de 17 aminoácidos (IASASCTTCICTCSCSS). Una vez que se sintetiza el precursor, la ciclodehidratasa tsrO y la deshidrogenasa tsrM catalizan la formación de tiazol o tiazolina a partir de cada residuo de cisteína en la cadena peptídica. Después de la formación de tiazol/tiazolina, las deshidratasas tsrJ, K y S convierten todos los residuos de serina en deshidroalaninas. Bycroft sugirió una heterociclación de Diels-Alder de la deshidropiperidina central (en S5, C13 y S14) en 1978 y Nicolaou et al. en 2005. Kelly et al . también han sugerido un mecanismo alternativo de formación de deshidropiperidina . en 2009. Sin embargo, según la evidencia experimental, se sugiere que tsrN y L son responsables de la heterociclación de Diels-Alder. Se sugiere que la fracción de ácido quinaldico sea sintetizada por los nueve genes tsrFAEBDUPQI a partir de triptófano y luego da como resultado el cierre del macrociclo del ácido quinaldico. Por último, tsrR sirve como candidato para la oxidación del residuo Ile para producir tiostreptona. [ cita necesaria ]
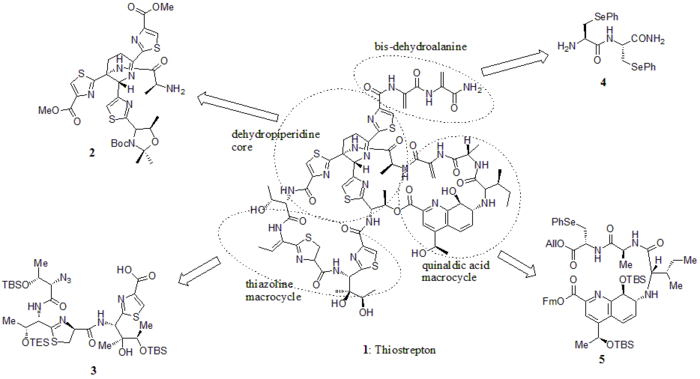
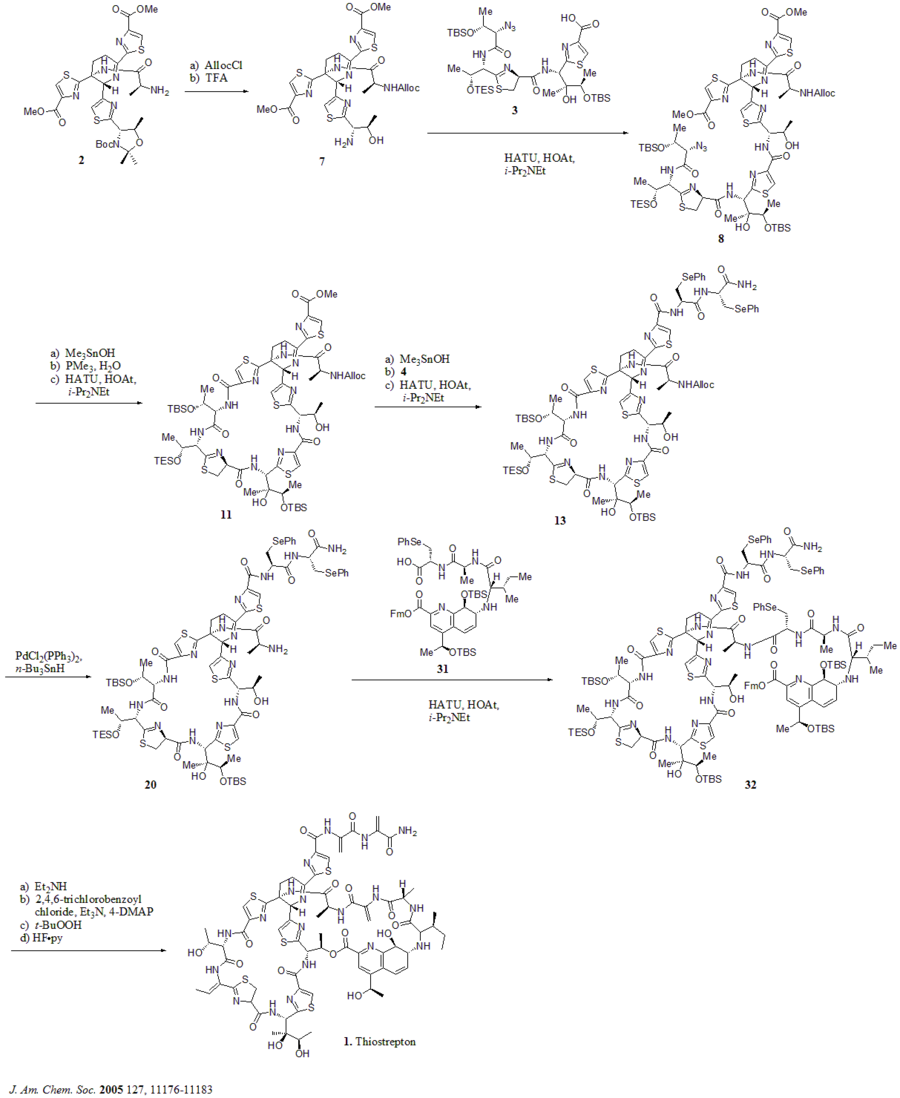
En 2005, Nicolaou et al. publicó la síntesis total de tiostrepton. Al principio, construyeron los componentes clave del tiostreptón (1): núcleo de deshidropiperidina (2), macrociclo de tiazolina (3), cola de bis-deshidroalanina (4) y macrociclo de ácido quinaldico (5). Luego ensamblaron los bloques de construcción secuencialmente como se muestra en el esquema sintético (los números compuestos provienen de la referencia).