El mononitruro de azufre es un compuesto inorgánico con la fórmula molecular SN. Es el análogo de azufre del óxido nítrico radical , NO, y es isoelectrónico con respecto a este. Se detectó inicialmente en 1975, en el espacio exterior, en nubes moleculares gigantes y, más tarde, en la coma de los cometas. [1] Esto estimuló más estudios de laboratorio del compuesto. De manera sintética, se produce por descarga eléctrica en mezclas de compuestos de nitrógeno y azufre, o por combustión en fase gaseosa y por fotólisis en solución. [2]
El radical NS es una especie altamente transitoria, con una vida útil del orden de milisegundos, pero se puede observar espectroscópicamente durante períodos cortos de tiempo a través de varios métodos de generación. El NS es demasiado reactivo para aislarlo como sólido o líquido, y solo se ha preparado como vapor en matrices de baja presión o baja temperatura debido a su tendencia a oligomerizarse rápidamente a especies diamagnéticas más estables. [3]
La transmisión de una descarga eléctrica a través de un tubo de vidrio con ventanas de cuarzo que contienen una mezcla de nitrógeno y vapor de azufre (rigurosamente libre de oxígeno) da como resultado que el espectro de luz emitida gane bandas consistentes con la formación de NS. [4]
Al pasar una mezcla de N 2 y S 2 Cl 2 gaseosos a través del brazo lateral de una celda de absorción sometida a descarga de microondas se produce NS. La espectroscopia de láser de diodo infrarrojo realizada con este método permitió derivar la constante rotacional de equilibrio y, por lo tanto, calcular la longitud de enlace de equilibrio como 1,4940 Å. [5]
Con la descarga de nitrógeno y azufre elementales por microondas a baja presión, seguida de su atrapamiento a baja temperatura en matrices de argón, se obtiene una mezcla de productos que incluye NS, NNS, SNS y NSS. Al agregar un exceso de azufre, también se produce SSNS. [6]
El metano se mezcló previamente con combustible en forma de O2 , N2O o aire y se quemó a presión ambiente. La fuente de nitrógeno se introdujo mediante la adición de 1-5 mol % de gas NH3 y azufre mediante 0,01-0,5 mol % de gas H2S o SF6 . Se observa una concentración de estado estable de NS dentro del frente de llama mediante el espectro de fluorescencia inducida por láser (LIF). [7]
El radical NS se detectó mediante el espectro LIF como producto de la fotólisis del gas tetrasulfuro de tetranitrógeno (N 4 S 4 ) mediante un láser de 248 nm. [8]
Las soluciones aireadas de Cr(CH3CN ) 5 ( NS) 2+ son altamente fotoactivas y propensas a una rápida descomposición. Las soluciones desaireadas de Cr(CH3CN ) 5 ( NS) 2+ en acetonitrilo son estables siempre que se mantengan en la oscuridad. La fotólisis continua con luz de 366 nm es lenta, mientras que el uso de un láser pulsado de 355 nm da como resultado una labilización más rápida del NS. [9]
La evidencia sugiere que el NS puede reaccionar consigo mismo para alcanzar N 2 S 2 , N 4 S 4 y polímeros de la forma (NS) x . (NS) x se forma a partir de la polimerización de ciclo-N 2 S 2 . [3]



El trans -NSSN resulta de la dimerización directa de NS. [3]

Se ha observado N 3 S 3 mediante espectroscopia fotoelectrónica de vapores del polímero (SN) x , pero aún no se ha caracterizado más. Los intentos de producir N 3 S 3 mediante oxidación de [PPN] [S 3 N 3 ] no tuvieron éxito. [10] Se teoriza que la dimerización rápida a (N 3 S 3 ) 2 desproporcionará irreversiblemente a N 4 S 4 y N 2 S 2 . [3]

El tiempo de desintegración radical de NS solo es del orden de 1-3 ms. Como es evidente por la ausencia de cambios en este tiempo de desintegración tras la adición de NO u O 2 a temperatura ambiente, el radical NS no es reactivo con NO y O 2 . Sin embargo, se observa una rápida desintegración de primer orden con la adición de NO 2 . Se propone que esta reacción proceda a través de varios intermediarios, alcanzando finalmente los productos finales de N 2 y SO 2 . [8] Esta reacción rápida ocurre con una constante de velocidad de k = (2,54 ± 0,12) × 10 −11 cm 3 moléculas −1 s −1 a 295 K. Mediante el uso de cálculos computacionales basados en la teoría funcional de la densidad , se han predicho los mínimos y estados de transición de la superficie de energía potencial de esta reacción. [8]
Se cree que dentro de la coma interna de los cometas se producen muchas reacciones que son relevantes para la formación y reactividad del radical NS. [11]
Como ligando, el NS actúa como un donante σ y un aceptor π, formando complejos de metal-tionitrosilo. Los complejos de metal de transición-tionitrosilo se han preparado mediante los siguientes procedimientos: [12]
A partir de la cristalografía de rayos X de muchos de estos complejos de metal-tionitrosilo, se puede observar que el ángulo de enlace MNS es casi lineal, lo que sugiere una hibridación sp alrededor de N. Las distancias cortas MN y las distancias largas NS reflejan la estructura de resonancia de M=N=S que tiene una mayor contribución que MN≡S. [12]
Las frecuencias de estiramiento IR v (NS) típicas son aproximadamente 1065 cm −1 para complejos de metales de transición de baja valencia y alrededor de 1390 cm −1 en los casos de alta valencia, mientras que el radical en fase gaseosa libre exhibe una señal de 1204 cm −1 . [3]
Las estructuras electrónicas de Fe(S 2 CNMe 2 ) 2 (NE), donde E=O, S o Se, se calcularon utilizando métodos de la teoría funcional de la densidad . Se encontró que la gran densidad de espín de Mulliken permaneció concentrada en el núcleo de Fe(NE) y las distancias Fe-N experimentaron pocos cambios con respecto al átomo de calcógeno utilizado. El HOMO de los complejos de nitrosilo y tionitrosilo mantuvo el carácter 1a 1 (d z 2 ). Los pequeños cambios en las energías de los orbitales de espín de los complejos, en particular la disminución de la brecha energética entre los orbitales 2b 2 y 1b 1 y 2b 1 y 1b 1 , se atribuyen a que el NS es un aceptor π más débil que el NO. [9]
Cuando un agente atrapante de espín, como Fe(S 2 CNEt 2 ) 2 está presente durante la fotólisis de Cr(CH 3 CN) 5 (NS) 2+ , se observan nuevas bandas EPR S=1/2, atribuidas a la formación de Fe(S 2 CNEt 2 ) 2 (NS), y la señal de Cr(CH 3 CN) 5 (NS) 2+ desaparece. Esto sugiere que el radical NS se ha transferido del complejo de cromo al complejo de hierro. [9]

Esto fue particularmente significativo ya que fue la primera reactividad controlada y bien caracterizada del NS en solución. Además, mostró el potencial de una reactividad similar en reacciones conocidas con NO, como el uso de este complejo de ditiocarbamato de hierro. [3]

Los electrones de valencia de este compuesto coinciden con los del óxido nítrico . El mononitruro de azufre puede describirse como un promedio de un conjunto de estructuras de resonancia . La estructura de enlace simple (primera estructura de resonancia mostrada) tiene poca contribución. Se considera que el orden de enlace formal es 2,5.

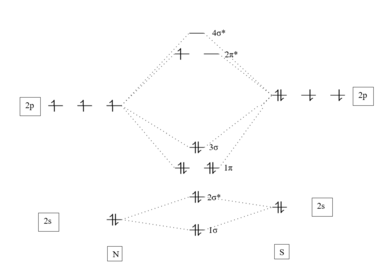
La disminución de la electronegatividad con calcogenuros cada vez más pesados conduce a una inversión del dipolo. En NO, el oxígeno es el elemento más electronegativo. En NS, el nitrógeno es más electronegativo. El radical NS es significativamente más inestable y propenso a la concatenación que el NO. [3]
Las moléculas de regiones astronómicas distantes se pueden identificar en función de sus transiciones rotacionales únicas, cuyas frecuencias de microondas correspondientes son detectables por antenas en la Tierra. La presencia de mononitruro de azufre interestelar se informó por primera vez en 1975 mediante cartas consecutivas publicadas en el Astrophysical Journal.
La NS interestelar se identificó por primera vez en la nube molecular gigante Sagitario B2 (Sgr B2). Su presencia se informó en dos artículos simultáneos. Las mediciones realizadas con el telescopio del Observatorio Nacional de Radioastronomía en Kitt Peak, Arizona, detectaron radiación de longitud de onda milimétrica en Sgr B2 atribuida a transiciones de estado c de NS en el estado 2 Π 1/2 de J=5/2 a J=3/2 a 115,16 GHz. [15] Esta asignación también fue confirmada por mediciones realizadas en el Observatorio de Ondas Milimétricas de la Universidad de Texas en el Monte Locke, que demostraron transiciones de estado c y estado d de J=5/2 a J=3/2 a 115,16 GHz y 115,6 GHz, respectivamente. Las interacciones hiperfinas surgen de momentos magnéticos y cuadrupolos eléctricos de 14 N. [16]
Se ha detectado NS en regiones responsables de la formación de estrellas masivas, como nubes moleculares gigantes como Sg B2 y nubes oscuras y frías como L134N y TMC-1. Un estudio encontró NS en 12 de las 14 GMC estudiadas, observando además las transiciones de J=7/2 a J=5/2 y de J=3/2 a J=1/2 a 161 y 69 GHz, respectivamente. La abundancia de NS en estas regiones se aproximó en función de la relación entre las intensidades de las líneas hiperfinas observadas e intrínsecas, así como mediante un modelo utilizando un programa de equilibrio estadístico, encontrando una baja abundancia en todas ellas, excepto en la nube molecular de Orión. [17]
También se observó NS en la coma de los cometas Hyakutake y Hale-Bopp . Se cree que la abundancia observada es mayor que la de los modelos de iones-moléculas en fase gaseosa debido a una especie no identificada, X-NS, que se fotodisocia para liberar NS. [11]
La detección de NS en concentración de estado estable en la zona de reacción de la combustión de metano dopado con amoníaco y un azufre combustible como H2S sugiere que el NS puede ser un intermediario reactivo importante en la quema de llamas de hidrocarburos en una atmósfera reductora, lo que es relevante para la pirólisis y combustión del carbón. [7]
Los combustibles fósiles contienen nitrógeno ligado, que libera niveles elevados de emisiones de óxido nítrico durante la combustión. Las emisiones de NO x se pueden controlar mediante la desnitrificación de la fuente de combustible, la modificación de la cámara de combustión o ambas. Una técnica en desarrollo es la recombustión de NO x , que se reduce a N 2 . Estos combustibles también contienen cantidades variables de azufre, que se oxida a SO 2 . Por lo tanto, comprender la reactividad de NO y SO 2 es crucial para el proceso de recombustión. El aparato experimental para probar esto implicó una llama primaria para producir productos de combustión, que se mezclaron con NO y SO 2 para imitar los subproductos de la quema de carbón. Esta mezcla se alimentó al quemador a presión atmosférica. Se observa una disminución del 1-2% en la concentración de NO x en varios porcentajes de la entrada total de combustible (relación de recombustión) en presencia de 0,1% de SO 2 , que se atribuye a la formación de H 2 S, HS y la reacción resultante con NO, dando lugar a NS. Reacción: HS + NO > NS + OH. [18]