- dióxido de tiourea , un agente reductor utilizado en textiles
- hipotaurina , un intermediario biosintético
- Rongalita , una fuente de "SO 2 2− "
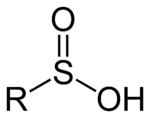
Los ácidos sulfínicos son oxoácidos de azufre con la estructura RSO(OH). En estos compuestos organosulfurados , el azufre es piramidal . [1]
Los ácidos sulfínicos RSO 2 H son aproximadamente 1000 veces más ácidos que el ácido carboxílico correspondiente RCO 2 H. [ cita requerida ] El azufre es piramidal, por lo tanto, los ácidos sulfínicos son quirales. Los ácidos libres son típicamente inestables, desproporcionados con respecto al ácido sulfónico RSO 3 H y al tiosulfonato RSSO 3 R. [2] : 679
La alquilación de ácidos sulfínicos puede dar sulfonas o ésteres de sulfinato , dependiendo del disolvente y del reactivo. Los reactivos fuertemente polarizados (por ejemplo, tetrafluoroborato de trimetiloxonio ) dan ésteres, mientras que los reactivos relativamente no polarizados (por ejemplo, un haluro de alquilo o enona ) dan sulfonas. [2] : 682 Los sulfinatos reaccionan con reactivos de Grignard para dar sulfóxidos y experimentan una variante de la condensación de Claisen hacia el mismo fin. [2] : 686
Las sales de cobalto (III) pueden oxidar los ácidos sulfínicos a disulfonas, aunque los rendimientos son solo del 30 al 50 %. [3]
Los ácidos sulfínicos se preparan a menudo in situ mediante la acidificación de las sales de sulfinato correspondientes , que suelen ser más robustas que el ácido. Estas sales se generan mediante la reducción de cloruros de sulfonilo con metales, [4] aunque los tiolatos también reducen los tioésteres de sulfonato a un sulfinato y un disulfuro . [2] : 681
Una vía alternativa es la reacción de reactivos de Grignard con dióxido de azufre . Los sulfinatos de metales de transición también se generan por inserción de dióxido de azufre en alquilos metálicos, una reacción que puede realizarse a través de un complejo de dióxido de azufre y metal .
Las sulfonas pueden eliminarse en base, particularmente si está presente un nucleófilo fuerte ; así, por ejemplo, el cianuro de sodio hace que la bis(2-butanona-4-il) sulfona se divida en levulinonitrilo y ácido 3-oxobutano 1-sulfínico: [2] : 681
Se supone que el nitrilo se forma mediante la adición conjugada de cianuro a la enona correspondiente .
La adición de cloruro de tionilo a un alqueno mediante el método de Friedel-Crafts produce un cloruro de α-clorosulfinilo, que normalmente forma un complejo con un ácido de Lewis. Asimismo, un carbanión puede atacar al cloruro de tionilo para formar un cloruro de sulfinilo. Una hidrólisis cuidadosa produce un ácido sulfínico. [2] : 682, 684
El ácido sulfínico no sustituido, cuando R es el átomo de hidrógeno, es un isómero de mayor energía del ácido sulfoxílico , ambos inestables.
Un ejemplo de un ácido sulfínico simple y bien estudiado es el ácido fenilsulfínico . Un ácido sulfínico comercialmente importante es el dióxido de tiourea , que se prepara mediante la oxidación de tiourea con peróxido de hidrógeno . [2]
Otro ácido sulfínico de importancia comercial es el ácido hidroximetilsulfínico, que se emplea habitualmente en forma de sal sódica (HOCH 2 SO 2 Na). Este anión, llamado Rongalita , también es comercialmente útil como agente reductor.
La base conjugada de un ácido sulfínico es un anión sulfinato . La enzima cisteína dioxigenasa convierte la cisteína en el sulfinato correspondiente. Un producto de esta reacción catabólica es la hipotaurina del ácido sulfínico . El término sulfinito también describe los ésteres del ácido sulfínico. Los ésteres de sulfinito cíclicos se denominan sultinas .
{{cite journal}}: Requiere citar revista |journal=( ayuda )Mantenimiento de CS1: varios nombres: lista de autores ( enlace ){{cite journal}}: Requiere citar revista |journal=( ayuda )