
La sublimación es la transición de una sustancia directamente del estado sólido al estado gaseoso , sin pasar por el estado líquido . [1] La forma verbal de sublimación es sublime , o menos preferiblemente, sublimar . [2] Sublimar también se refiere al producto obtenido por sublimación. [2] [3] El punto en el que la sublimación ocurre rápidamente (para más detalles, véase más abajo) se denomina punto crítico de sublimación, o simplemente punto de sublimación. Ejemplos notables incluyen la sublimación del hielo seco a temperatura ambiente y presión atmosférica, y la del yodo sólido con calentamiento.
El proceso inverso de la sublimación es la deposición (también llamada desublimación ), en el que una sustancia pasa directamente de una fase gaseosa a una sólida, sin pasar por el estado líquido. [4]
Técnicamente, todos los sólidos pueden sublimar, aunque la mayoría sublima a velocidades extremadamente bajas en condiciones habituales que son difícilmente detectables. A presiones normales , la mayoría de los compuestos y elementos químicos poseen tres estados diferentes a diferentes temperaturas . En estos casos, la transición del estado sólido al estado gaseoso requiere un estado líquido intermedio. La presión a la que se hace referencia es la presión parcial de la sustancia, no la presión total (p. ej., atmosférica) de todo el sistema. Por lo tanto, cualquier sólido puede sublimar si su presión de vapor es mayor que la presión parcial circundante de la misma sustancia y, en algunos casos, sublima a una velocidad apreciable (p. ej., hielo de agua justo por debajo de 0 °C).
En el caso de algunas sustancias, como el carbono y el arsénico , la sublimación desde el estado sólido es mucho más fácil que la evaporación desde el estado líquido y es difícil obtenerlas en estado líquido. Esto se debe a que la presión de su punto triple en su diagrama de fases (que corresponde a la presión más baja a la que la sustancia puede existir en estado líquido) es muy alta.
La sublimación se produce por la absorción de calor, que proporciona suficiente energía para que algunas moléculas superen las fuerzas de atracción de sus vecinas y escapen a la fase de vapor. Dado que el proceso requiere energía adicional, la sublimación es un cambio endotérmico . La entalpía de sublimación (también llamada calor de sublimación) se puede calcular sumando la entalpía de fusión y la entalpía de vaporización .
Si bien la definición de sublimación es simple, a menudo existe confusión en cuanto a qué se considera una sublimación.
La vaporización (de líquido a gas) se divide en dos tipos: la vaporización en la superficie del líquido se denomina evaporación y la vaporización en el punto de ebullición con formación de burbujas en el interior del líquido se denomina ebullición . Sin embargo, no existe tal distinción para la transición de sólido a gas, que siempre se denomina sublimación en ambos casos correspondientes.
Para mayor claridad, es necesario distinguir entre los dos casos correspondientes. Con referencia a un diagrama de fases , la sublimación que ocurre a la izquierda del límite sólido-gas, el punto triple o el límite sólido-líquido (que corresponde a la evaporación en la vaporización) puede llamarse sublimación gradual ; y la sustancia sublima gradualmente , independientemente de la velocidad. La sublimación que ocurre en el límite sólido-gas (punto crítico de sublimación) (que corresponde a la ebullición en la vaporización) puede llamarse sublimación rápida , y la sustancia sublima rápidamente . Las palabras "gradual" y "rápida" han adquirido significados especiales en este contexto y ya no describen la velocidad de sublimación. [ cita requerida ]
El término sublimación se refiere específicamente a un cambio físico de estado y no se utiliza para describir la transformación de un sólido en gas en una reacción química. Por ejemplo, la disociación al calentar el cloruro de amonio sólido en cloruro de hidrógeno y amoníaco no es sublimación sino una reacción química. De manera similar, la combustión de velas que contienen parafina en dióxido de carbono y vapor de agua no es sublimación sino una reacción química con oxígeno.
La sublimación se utiliza históricamente como un término genérico para describir una transición de fase de dos pasos: una transición de sólido a gas (sublimación en una definición más precisa) seguida de una transición de gas a sólido ( deposición ). [5] [6] (Ver más abajo)
Los ejemplos mostrados son sustancias que subliman notablemente bajo determinadas condiciones.
.jpg/440px-Dry_Ice_Vapor_(17490553041).jpg)
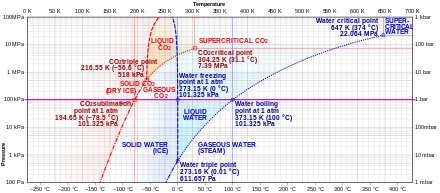
El dióxido de carbono sólido ( hielo seco ) sublima rápidamente a lo largo del límite sólido-gas (punto de sublimación) por debajo del punto triple (por ejemplo, a la temperatura de -78,5 °C, a presión atmosférica ), mientras que su fusión en CO2 líquido puede ocurrir a lo largo del límite sólido-líquido ( punto de fusión ) a presiones y temperaturas superiores al punto triple (es decir, 5,1 atm, -56,6 °C).
La nieve y el hielo subliman gradualmente a temperaturas inferiores al límite sólido-líquido (punto de fusión) (generalmente 0 °C), y a presiones parciales inferiores a la presión del punto triple de 612 Pa (0,00604 atm), a una velocidad baja. [7] En la liofilización , el material que se va a deshidratar se congela y se permite que su agua sublime bajo presión reducida o vacío. La pérdida de nieve de un campo de nieve durante una ola de frío suele deberse a la acción directa de la luz solar sobre las capas superiores de la nieve. La sublimación del hielo es un factor del desgaste erosivo del hielo glaciar , también llamado ablación en glaciología . [ cita requerida ]


El naftaleno , un compuesto orgánico que se encuentra comúnmente en pesticidas como las bolas de naftalina , se sublima fácilmente porque está hecho de moléculas no polares que se mantienen unidas solo por fuerzas intermoleculares de van der Waals . El naftaleno es un sólido que se sublima gradualmente a temperatura y presión estándar , [8] a una velocidad alta, con el punto crítico de sublimación alrededor de 80 °C (176 °F). [9] A baja temperatura, su presión de vapor es lo suficientemente alta, 1 mmHg a 53 °C, [10] para hacer que la forma sólida de naftaleno se evapore en gas. En superficies frías, los vapores de naftaleno se solidificarán para formar cristales con forma de aguja.
El yodo se sublima gradualmente y produce vapores visibles al calentarlo suavemente a temperatura atmosférica estándar . Es posible obtener yodo líquido a presión atmosférica controlando la temperatura justo entre el punto de fusión y el punto de ebullición del yodo. En la ciencia forense , el vapor de yodo puede revelar huellas dactilares latentes en el papel. [11]

A presión atmosférica , el arsénico sublima gradualmente al calentarse y sublima rápidamente a 887 K (614 °C). [12]
El cadmio y el zinc se subliman mucho más que otros materiales comunes, por lo que no son materiales adecuados para su uso en vacío . [ cita requerida ]

La sublimación es una técnica utilizada por los químicos para purificar compuestos . Normalmente, se coloca un sólido en un aparato de sublimación y se calienta al vacío . Bajo esta presión reducida , el sólido se volatiliza y se condensa como un compuesto purificado sobre una superficie enfriada ( dedo frío ), dejando atrás un residuo no volátil de impurezas . Una vez que cesa el calentamiento y se elimina el vacío, el compuesto purificado se puede recoger de la superficie de enfriamiento. [13] [14] Para lograr eficiencias de purificación aún mayores, se aplica un gradiente de temperatura , que también permite la separación de diferentes fracciones. Las configuraciones típicas utilizan un tubo de vidrio evacuado que se calienta gradualmente de manera controlada. El flujo de material es desde el extremo caliente, donde se coloca el material inicial, hasta el extremo frío que está conectado a un soporte de bomba. Al controlar las temperaturas a lo largo del tubo, el operador puede controlar las zonas de recondensación, con compuestos muy volátiles que se bombean fuera del sistema por completo (o se atrapan en una trampa de frío separada ), compuestos moderadamente volátiles que se recondensan a lo largo del tubo según sus diferentes volatilidades y compuestos no volátiles que permanecen en el extremo caliente. La sublimación al vacío de este tipo también es el método de elección para la purificación de compuestos orgánicos para su uso en la industria de la electrónica orgánica , donde se necesitan purezas muy altas (a menudo > 99,99%) para satisfacer los estándares de la electrónica de consumo y otras aplicaciones. [ cita requerida ]
En la alquimia antigua , una protociencia que contribuyó al desarrollo de la química y la medicina modernas, los alquimistas desarrollaron una estructura de técnicas básicas de laboratorio, teoría, terminología y métodos experimentales. La sublimación se usaba para referirse al proceso en el que una sustancia se calienta hasta convertirse en vapor y luego se acumula inmediatamente como sedimento en la parte superior y el cuello del medio de calentamiento (normalmente una retorta o un alambique ), pero también se puede usar para describir otras transiciones similares que no se realizan en el laboratorio. Fue mencionada por autores alquímicos como Basil Valentine y George Ripley , y en el Rosarium philosophorum , como un proceso necesario para la finalización de la obra magna . Aquí, la palabra sublimación se usó para describir un intercambio de "cuerpos" y "espíritus" similar a la transición de fase de laboratorio entre sólidos y gases. Valentine, en su Le char triomphal de l'antimoine (Carro triunfal de antimonio, publicado en 1646) hizo una comparación con la espagiria en la que se puede utilizar una sublimación vegetal para separar los espíritus del vino y la cerveza. [15] Ripley utilizó un lenguaje más indicativo de las implicaciones místicas de la sublimación, indicando que el proceso tiene un doble aspecto en la espiritualización del cuerpo y la corporalización del espíritu. [16] Escribe: [17]
Y hacemos sublimaciones por tres causas:
la primera es hacer espiritual el cuerpo;
la segunda es que el espíritu sea corpóreo
y se fije con él y sea consustancial;
la tercera es que, de su sucio origen,
se purifique y
disminuya en él su salinidad sulfúrica, que es contagiosa.
La entalpía de sublimación se ha predicho comúnmente usando el teorema de equipartición . Si se supone que la energía reticular es aproximadamente la mitad de la energía de empaquetamiento, [ aclaración necesaria ] entonces se pueden aplicar las siguientes correcciones termodinámicas para predecir la entalpía de sublimación. Suponiendo un gas ideal de 1 molar se obtiene una corrección para el entorno termodinámico (presión y volumen) en el que pV = RT, por lo tanto una corrección de 1RT. Luego se deben aplicar correcciones adicionales para las vibraciones , rotaciones y traslación. Del teorema de equipartición, la rotación y la traslación gaseosas contribuyen con 1,5RT cada una al estado final, por lo tanto una corrección de +3RT. Las vibraciones y rotaciones cristalinas contribuyen con 3RT cada una al estado inicial, por lo tanto −6RT. Sumando las correcciones RT; −6RT + 3RT + RT = −2RT. [18] Esto conduce a la siguiente entalpía de sublimación aproximada. Se puede encontrar una aproximación similar para el término de entropía si se suponen cuerpos rígidos. [19] [20]
La impresión por sublimación es una tecnología de impresión digital que utiliza ilustraciones a todo color que funcionan con sustratos recubiertos de poliéster y polímero. También conocido como sublimación digital, el proceso se utiliza comúnmente para decorar prendas de vestir, carteles y pancartas, así como artículos novedosos como fundas para teléfonos móviles, placas, tazas de café y otros artículos con superficies aptas para sublimación. El proceso utiliza la ciencia de la sublimación, en la que se aplica calor y presión a un sólido, convirtiéndolo en un gas a través de una reacción endotérmica sin pasar por la fase líquida. [ cita requerida ]
En la impresión por sublimación, los tintes de sublimación únicos se transfieren a hojas de papel de “transferencia” mediante tinta de gel líquido a través de un cabezal de impresión piezoeléctrico. La tinta se deposita en estos papeles de inyección de tinta de alta liberación, que se utilizan para el siguiente paso del proceso de impresión por sublimación. Después de que el diseño digital se imprime en hojas de transferencia de sublimación, se coloca en una prensa de calor junto con el sustrato que se va a sublimar. [ cita requerida ]
Para transferir la imagen del papel al sustrato, se requiere un proceso de prensado térmico que es una combinación de tiempo, temperatura y presión. La prensa térmica aplica esta combinación especial, que puede cambiar según el sustrato, para “transferir” los tintes de sublimación a nivel molecular al sustrato. Los tintes más comunes utilizados para la sublimación se activan a 350 grados Fahrenheit. Sin embargo, normalmente se recomienda un rango de 380 a 420 grados Fahrenheit para obtener un color óptimo. [ cita requerida ]
El resultado del proceso de sublimación es una impresión a todo color, de alta resolución y casi permanente. Debido a que los tintes se infunden en el sustrato a nivel molecular, en lugar de aplicarse a nivel tópico (como en la serigrafía y la impresión directa sobre prendas), las impresiones no se agrietarán, desteñirán ni se desprenderán del sustrato en condiciones normales. [ cita requerida ]