La química del estado sólido , también denominada a veces química de materiales , es el estudio de la síntesis , la estructura y las propiedades de los materiales en fase sólida. Por lo tanto, tiene una fuerte superposición con la física del estado sólido , la mineralogía , la cristalografía , la cerámica , la metalurgia , la termodinámica , la ciencia de los materiales y la electrónica, con un enfoque en la síntesis de nuevos materiales y su caracterización. Una amplia gama de técnicas sintéticas, como el método cerámico y la deposición química de vapor , producen materiales en estado sólido. Los sólidos se pueden clasificar como cristalinos o amorfos en función de la naturaleza del orden presente en la disposición de sus partículas constituyentes. [1] Sus composiciones elementales, microestructuras y propiedades físicas se pueden caracterizar a través de una variedad de métodos analíticos.

Debido a su relevancia directa para los productos comerciales, la química inorgánica del estado sólido ha sido fuertemente impulsada por la tecnología. El progreso en el campo a menudo ha sido impulsado por las demandas de la industria, a veces en colaboración con la academia. [2] Las aplicaciones descubiertas en el siglo XX incluyen catalizadores basados en zeolita y platino para el procesamiento de petróleo en la década de 1950, silicio de alta pureza como componente central de dispositivos microelectrónicos en la década de 1960 y superconductividad de "alta temperatura" en la década de 1980. La invención de la cristalografía de rayos X a principios de la década de 1900 por William Lawrence Bragg fue una innovación facilitadora. Nuestra comprensión de cómo ocurren las reacciones a nivel atómico en el estado sólido avanzó considerablemente gracias al trabajo de Carl Wagner sobre la teoría de la tasa de oxidación, la contradifusión de iones y la química de defectos. Debido a sus contribuciones, a veces se lo ha llamado el padre de la química del estado sólido . [3]
Dada la diversidad de compuestos en estado sólido, se utiliza una gama igualmente diversa de métodos para su preparación. [1] [4] La síntesis puede variar desde métodos de alta temperatura, como el método cerámico, hasta métodos de gas, como la deposición química en fase de vapor . A menudo, los métodos evitan la formación de defectos [5] o producen productos de alta pureza. [6]
El método cerámico es una de las técnicas de síntesis más comunes. [7] La síntesis se produce completamente en estado sólido. [7] Los reactivos se muelen juntos, se forman en pellets utilizando una prensa de pellets y una prensa hidráulica, y se calientan a altas temperaturas. [7] Cuando la temperatura de los reactivos es suficiente, los iones en los límites de grano reaccionan para formar las fases deseadas. Generalmente, los métodos cerámicos dan polvos policristalinos, pero no cristales individuales.
Utilizando un mortero o un molino de bolas , los reactivos se muelen juntos, lo que disminuye el tamaño y aumenta el área superficial de los reactivos. [8] Si la mezcla no es suficiente, podemos utilizar técnicas como la coprecipitación y el sol-gel . [7] Un químico forma pellets a partir de los reactivos molidos y coloca los pellets en recipientes para calentarlos. [7] La elección del recipiente depende de los precursores, la temperatura de reacción y el producto esperado. [7] Por ejemplo, los óxidos metálicos se sintetizan típicamente en recipientes de sílice o alúmina. [7] Un horno de tubo calienta el pellet. [7] Los hornos de tubo están disponibles hasta temperaturas máximas de 2800 o C. [9]

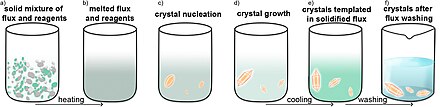
La síntesis de fundente fundido puede ser un método eficiente para obtener monocristales. En este método, los reactivos de partida se combinan con fundente, un material inerte con un punto de fusión inferior al de los materiales de partida. El fundente sirve como disolvente. Después de la reacción, el exceso de fundente se puede eliminar mediante un disolvente adecuado o se puede calentar de nuevo para eliminar el fundente por sublimación si se trata de un compuesto volátil.
Los materiales del crisol tienen un papel importante en la síntesis de fundente fundido. El crisol no debe reaccionar con el fundente ni con el reactivo de partida. Si alguno de los materiales es volátil, se recomienda realizar la reacción en una ampolla sellada. Si la fase de destino es sensible al oxígeno, a menudo se utiliza un tubo de sílice fundida recubierto de carbono o un crisol de carbono dentro de un tubo de sílice fundida que evita el contacto directo entre la pared del tubo y los reactivos.
El transporte de vapor químico produce materiales muy puros. La reacción ocurre típicamente en una ampolla sellada. [10] Un agente de transporte, añadido a la ampolla sellada, produce una especie intermedia volátil a partir del reactivo sólido. [10] Para los óxidos metálicos, el agente de transporte es generalmente Cl2 o HCl. [10] La ampolla tiene un gradiente de temperatura y, a medida que el reactivo gaseoso viaja a lo largo del gradiente, finalmente se deposita como un cristal. [10] Un ejemplo de una reacción de transporte de vapor químico utilizada industrialmente es el proceso Mond . El proceso Mond implica calentar níquel impuro en una corriente de monóxido de carbono para producir níquel puro. [6]
La síntesis por intercalación es la inserción de moléculas o iones entre las capas de un sólido. [11] El sólido estratificado tiene enlaces intermoleculares débiles que mantienen unidas sus capas. [11] El proceso ocurre por difusión . [11] La intercalación es impulsada además por el intercambio iónico , reacciones ácido-base o reacciones electroquímicas . [11] El método de intercalación se utilizó por primera vez en China con el descubrimiento de la porcelana . Además, el grafeno se produce mediante el método de intercalación, y este método es el principio detrás de las baterías de iones de litio . [12]
Es posible utilizar disolventes para preparar sólidos por precipitación o por evaporación . [5] A veces, el disolvente es un hidrotermal que está bajo presión a temperaturas más altas que el punto de ebullición normal . [5] Una variación de este tema es el uso de métodos de fundente , que utilizan una sal con un punto de fusión relativamente bajo como disolvente. [5]

Muchos sólidos reaccionan vigorosamente con especies gaseosas como el cloro , el yodo y el oxígeno . [13] [14] Otros sólidos forman aductos , como el CO o el etileno . Estas reacciones se llevan a cabo en tubos abiertos por los que pasan los gases. Además, estas reacciones pueden tener lugar dentro de un dispositivo de medición como un TGA . En ese caso, se puede obtener información estequiométrica durante la reacción, lo que ayuda a identificar los productos.
La deposición química en fase de vapor es un método ampliamente utilizado para la preparación de recubrimientos y semiconductores a partir de precursores moleculares. [15] Un gas portador transporta los precursores gaseosos hasta el material a recubrir. [16]
Este es el proceso en el que se determinan la composición química, la estructura y las propiedades físicas de un material utilizando una variedad de técnicas analíticas.
La metodología sintética y la caracterización a menudo van de la mano en el sentido de que no se prepara una sino una serie de mezclas de reacción y se someten a un tratamiento térmico. La estequiometría , una relación numérica entre las cantidades de reactivo y producto, normalmente se varía sistemáticamente. Es importante encontrar qué estequiometrías conducirán a nuevos compuestos sólidos o soluciones sólidas entre los conocidos. Un método principal para caracterizar los productos de reacción es la difracción de polvo porque muchas reacciones de estado sólido producirán moldes o polvos policristalinos. La difracción de polvo ayuda a la identificación de fases conocidas en la mezcla. [17] Si se encuentra un patrón que no se conoce en las bibliotecas de datos de difracción, se puede intentar indexar el patrón. La caracterización de las propiedades de un material suele ser más fácil para un producto con estructuras cristalinas.

Una vez que se conoce la celda unitaria de una nueva fase, el siguiente paso es establecer la estequiometría de la fase. Esto se puede hacer de varias maneras. A veces, la composición de la mezcla original dará una pista, en el caso de que solo se encuentre un producto con un patrón de polvo único o se obtenga una fase de una determinada composición por analogía con un material conocido, pero esto es poco frecuente.
A menudo, se requiere un esfuerzo considerable en el refinamiento de los procedimientos sintéticos para obtener una muestra pura del nuevo material. Si es posible separar el producto del resto de la mezcla de reacción, se pueden utilizar métodos de análisis elemental como la microscopía electrónica de barrido (SEM) y la microscopía electrónica de transmisión (TEM). La detección de electrones dispersos y transmitidos desde la superficie de la muestra proporciona información sobre la topografía de la superficie y la composición del material. [18] La espectroscopia de rayos X de energía dispersiva (EDX) es una técnica que utiliza la excitación de un haz de electrones. La excitación de la capa interna de un átomo con electrones incidentes emite rayos X característicos con energía específica para cada elemento. [19] La energía de pico puede identificar la composición química de una muestra, incluida la distribución y la concentración. [19]
.jpg/440px-XRD_(Whole).jpg)
De manera similar a la EDX, el análisis por difracción de rayos X (XRD) implica la generación de rayos X característicos tras la interacción con la muestra. La intensidad de los rayos difractados dispersos en diferentes ángulos se utiliza para analizar las propiedades físicas de un material, como la composición de fases y la estructura cristalográfica. [20] Estas técnicas también se pueden combinar para lograr un mejor efecto. Por ejemplo, el SEM es un complemento útil para la EDX debido a su haz de electrones enfocado, que produce una imagen de gran aumento que proporciona información sobre la topografía de la superficie. [18] Una vez que se ha identificado el área de interés, se puede utilizar la EDX para determinar los elementos presentes en ese punto específico. La difracción de electrones de área seleccionada se puede combinar con TEM o SEM para investigar el nivel de cristalinidad y los parámetros de red de una muestra. [21]
La difracción de rayos X también se utiliza debido a sus capacidades de formación de imágenes y la velocidad de generación de datos. [22] Esto último a menudo requiere revisar y refinar los procedimientos preparativos y que están vinculados a la cuestión de qué fases son estables en qué composición y qué estequiometría. En otras palabras, cómo se ve el diagrama de fases . [23] Una herramienta importante para establecer esto son las técnicas de análisis térmico como DSC o DTA y cada vez más también, debido al advenimiento de los sincrotrones , la difracción de polvo dependiente de la temperatura. Un mayor conocimiento de las relaciones de fase a menudo conduce a un mayor refinamiento de los procedimientos sintéticos de forma iterativa. Las nuevas fases se caracterizan así por sus puntos de fusión y sus dominios estequiométricos. Esto último es importante para los muchos sólidos que son compuestos no estequiométricos. Los parámetros de celda obtenidos de XRD son particularmente útiles para caracterizar los rangos de homogeneidad de este último.
A diferencia de las grandes estructuras de los cristales, la estructura local describe la interacción de los átomos vecinos más cercanos. Los métodos de espectroscopia nuclear utilizan núcleos específicos para sondear los campos eléctricos y magnéticos alrededor del núcleo. Por ejemplo, los gradientes de campo eléctrico son muy sensibles a pequeños cambios causados por la expansión/compresión de la red (térmica o de presión), cambios de fase o defectos locales. Los métodos comunes son la espectroscopia Mössbauer y la correlación angular perturbada .
En el caso de los materiales metálicos, sus propiedades ópticas surgen de la excitación colectiva de los electrones de conducción. Las oscilaciones coherentes de los electrones bajo la radiación electromagnética, junto con las oscilaciones asociadas del campo electromagnético, se denominan resonancias de plasmón superficial . [24] La longitud de onda de excitación y la frecuencia de las resonancias de plasmón proporcionan información sobre el tamaño, la forma, la composición y el entorno óptico local de la partícula. [24]
En el caso de los materiales no metálicos o semiconductores , se pueden caracterizar por su estructura de bandas. Esta contiene un intervalo de banda que representa la diferencia de energía mínima entre la parte superior de la banda de valencia y la parte inferior de la banda de conducción. El intervalo de banda se puede determinar mediante espectroscopia ultravioleta-visible para predecir las propiedades fotoquímicas de los semiconductores. [25]
En muchos casos, los nuevos compuestos sólidos se caracterizan aún más [26] mediante una variedad de técnicas que abarcan la delgada línea que separa la química del estado sólido de la física del estado sólido. Consulte Caracterización en la ciencia de los materiales para obtener información adicional.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ){{cite book}}: Mantenimiento de CS1: otros ( enlace )