La amalgama de sodio , comúnmente denominada Na(Hg), es una aleación de mercurio y sodio . El término amalgama se utiliza para aleaciones, compuestos intermetálicos y soluciones (tanto soluciones sólidas como líquidas) que contienen mercurio como componente principal. Las amalgamas de sodio se utilizan a menudo en reacciones como agentes reductores fuertes con mejores propiedades de manipulación en comparación con el sodio sólido. Son menos peligrosamente reactivos con el agua y, de hecho, a menudo se utilizan como suspensión acuosa.
La amalgama de sodio se utilizaba como reactivo ya en 1862. [1] J. Alfred Wanklyn describió un método de síntesis en 1866. [2]
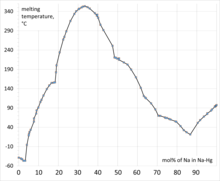
No se asigna ninguna fórmula particular a la "amalgama de sodio". Na 5 Hg 8 y Na 3 Hg son compuestos bien definidos. En las amalgamas de sodio, las distancias Hg-Hg se amplían a alrededor de 5 Å frente a aproximadamente 3 Å para el mercurio mismo. [3] Por lo general, las amalgamas se clasifican según el porcentaje en peso de sodio. Las amalgamas con 2% de Na son sólidas a temperatura ambiente, mientras que algunas amalgamas más diluidas permanecen líquidas. [4]
El sodio metálico se disuelve en mercurio de forma exotérmica , es decir, con liberación de calor, por lo que la formación de amalgama de sodio es famosa porque genera chispas. [5] El proceso provoca la ebullición localizada del mercurio y, por esta razón, la formación generalmente se lleva a cabo en una campana extractora y, a menudo, se realiza utilizando técnicas sin aire , como la síntesis bajo parafina líquida anhidra. La amalgama de sodio se puede preparar en el laboratorio disolviendo sodio metálico en mercurio o al revés. [6] [7] [8] Las amalgamas de sodio se pueden comprar en casas de suministros químicos.
La amalgama de sodio se ha utilizado en química orgánica como un poderoso agente reductor , que es más seguro de manipular que el propio sodio. Se utiliza en la degradación de Emde y también para la reducción de cetonas aromáticas a hidroles. [9]
En el diseño de la lámpara de sodio de alta presión se utiliza una amalgama de sodio que proporciona sodio para producir el color adecuado y mercurio para adaptar las características eléctricas de la lámpara.
La amalgama de sodio es un subproducto del cloro obtenido mediante electrólisis de celdas de mercurio . En esta celda, se electroliza salmuera (solución concentrada de cloruro de sodio ) entre un cátodo de mercurio líquido y un ánodo de titanio o grafito . El cloro se forma en el ánodo, mientras que el sodio formado en el cátodo se disuelve en el mercurio, formando amalgama de sodio. Normalmente, esta amalgama de sodio se extrae y se hace reaccionar con agua en una "celda descomponedora" para producir gas hidrógeno , una solución concentrada de hidróxido de sodio y mercurio que se reciclará durante el proceso. En principio, todo el mercurio debería reciclarse por completo, pero inevitablemente se pierde una pequeña parte. Debido a la preocupación de que este mercurio se escape al medio ambiente, el proceso de celdas de mercurio generalmente está siendo reemplazado por plantas que utilizan un cátodo menos tóxico.
{{cite journal}}: Mantenimiento CS1: nombres numéricos: lista de autores ( enlace ); Volumen Colectivo , vol. 2, pág. 607{{cite book}}: |journal=ignorado ( ayuda ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ); Volumen Colectivo , vol. 8, pág. 479