El modelo σ-π y el modelo de orbitales equivalentes se refieren a dos posibles representaciones de moléculas en la teoría de enlaces de valencia . El modelo σ-π diferencia enlaces y pares solitarios de simetría σ de aquellos de simetría π, mientras que el modelo de orbitales equivalentes los hibrida . El tratamiento σ-π tiene en cuenta la simetría molecular y es más adecuado para la interpretación de moléculas aromáticas ( regla de Hückel ), aunque los cálculos computacionales de ciertas moléculas tienden a optimizarse mejor bajo el tratamiento de orbitales equivalentes. [1] Las dos representaciones producen la misma densidad electrónica total y están relacionadas por una transformación unitaria de los orbitales moleculares ocupados; diferentes procedimientos de localización producen cualquiera de los dos. Se pueden construir dos orbitales equivalentes h y h ' tomando combinaciones lineales h = c 1 σ + c 2 π y h ' = c 1 σ – c 2 π para una elección apropiada de coeficientes c 1 y c 2 .
En una revisión de 1996, Kenneth B. Wiberg concluyó que "aunque no se puede hacer una declaración concluyente sobre la base de la información actualmente disponible, parece probable que podamos seguir considerando que las descripciones σ/π y de enlace doblado del etileno son equivalentes". [2] Ian Fleming va más allá en un libro de texto de 2010, señalando que "la distribución general de electrones [...] es exactamente la misma" en los dos modelos. [3] Sin embargo, como se señala en el libro de texto de Carroll, en niveles inferiores de la teoría, los dos modelos hacen predicciones cuantitativas y cualitativas diferentes, y ha habido un debate considerable sobre qué modelo es más útil conceptual y pedagógicamente. [4]
En la década de 1930 se propusieron dos explicaciones diferentes para la naturaleza de los enlaces covalentes dobles y triples en las moléculas orgánicas . Linus Pauling propuso que el doble enlace en el etileno resulta de dos orbitales tetraédricos equivalentes de cada átomo, [5] que más tarde se denominaron enlaces banana o enlaces tau . [6] Erich Hückel propuso una representación del doble enlace como una combinación de un enlace sigma más un enlace pi . [7] [8] [9] La representación σ-π es la más conocida y es la que se encuentra en la mayoría de los libros de texto desde finales del siglo XX.
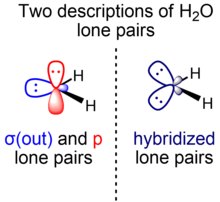
Inicialmente, el esquema del agua de Linus Pauling, tal como se presenta en su artículo principal sobre la teoría del enlace de valencia, consiste en dos pares solitarios no equivalentes de simetría σ y π. [5] Como resultado de desarrollos posteriores que resultaron en parte de la introducción de VSEPR, surgió una visión alternativa que considera que los dos pares solitarios son equivalentes, coloquialmente llamados orejas de conejo . [10]
Weinhold y Landis describen el uso adaptado a la simetría del concepto de hibridación orbital dentro del contexto de los orbitales de enlace naturales , una teoría orbital localizada que contiene análogos modernizados de pares de enlace clásicos (enlace de valencia/estructura de Lewis) y pares solitarios. [11] Para la molécula de fluoruro de hidrógeno, por ejemplo, dos pares solitarios F son esencialmente orbitales p no hibridados de simetría π, mientras que el otro es un orbital híbrido sp x de simetría σ. Una consideración análoga se aplica al agua (un par solitario O está en un orbital p puro, otro está en un orbital híbrido sp x ).
La cuestión de si es conceptualmente útil derivar orbitales equivalentes a partir de orbitales adaptados a la simetría, desde el punto de vista de la teoría de enlaces y la pedagogía, sigue siendo controvertida, con artículos recientes (2014 y 2015) que se oponen [12] y apoyan [13] la práctica.
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace )