La síntesis de oxazol de Fischer es una síntesis química de un oxazol a partir de una cianhidrina y un aldehído en presencia de ácido clorhídrico anhidro . [1] Este método fue descubierto por Emil Fischer en 1896. [2] La propia cianhidrina se deriva de un aldehído separado. Los reactivos de la propia síntesis de oxazol, la cianhidrina de un aldehído y el otro aldehído en sí, suelen estar presentes en cantidades equimolares. [3] Ambos reactivos suelen tener un grupo aromático , que aparece en posiciones específicas en el heterociclo resultante .
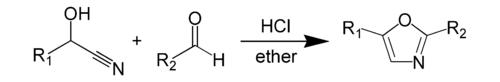
Un ejemplo más específico de síntesis de oxazol de Fischer implica la reacción del nitrilo de ácido mandélico con benzaldehído para producir 2,5-difenil-oxazol. [4]
Fischer desarrolló la síntesis de oxazol de Fischer durante su estancia en la Universidad de Berlín . La síntesis de oxazol de Fischer fue una de las primeras síntesis desarrolladas para producir oxazoles 2,5-disustituidos. [4]
La síntesis de oxazol de Fischer es un tipo de reacción de deshidratación que puede ocurrir en condiciones suaves en una reorganización de los grupos que no parecería posible. La reacción se produce disolviendo los reactivos en éter seco y haciendo pasar a través de la solución cloruro de hidrógeno seco y gaseoso . El producto, que es el oxazol 2,5-disustituido, precipita como clorhidrato y se puede convertir en la base libre mediante la adición de agua o mediante ebullición con alcohol. [1]
Las cianohidrinas y aldehídos utilizados para la síntesis son generalmente aromáticos , sin embargo ha habido casos en los que se han utilizado compuestos alifáticos . El primer paso del mecanismo es la adición de HCl gaseoso a la cianohidrina 1. La cianohidrina abstrae el hidrógeno del HCl mientras que el ion cloruro ataca el carbono en el grupo ciano . Este primer paso da como resultado la formación de un intermedio iminocloruro 2 , probablemente como la sal clorhidrato. Este intermedio reacciona luego con el aldehído ; el par solitario del nitrógeno ataca el carbono carbonílico electrófilo en el aldehído .
El siguiente paso da como resultado un ataque S N 2 seguido de la pérdida de agua para dar un intermedio de cloro-oxazolina 4 . A continuación se produce la tautomerización del protón del anillo a . El último paso implica una eliminación y la pérdida de una molécula de HCl para formar el producto 5 , que es el 2,5-diariloxazol. [4]

Los diarilazoles son motivos estructurales comunes tanto en productos naturales como en candidatos a fármacos, sin embargo, son difíciles de sintetizar. Los diariloxazoles generalmente se preparan mediante la síntesis de oxazol de Fischer o la síntesis de Robinson-Gabriel , donde el anillo de oxazol se construye mediante cualquiera de las síntesis. [5]
La síntesis de oxazol de Fischer también ha sido útil en la síntesis de 2-(4-bromofenil)5-feniloxazol a partir de cianhidrina de benzaldehído y 4-bromobenzaldehído. Sin embargo, la cloración del anillo de oxazol se produce para dar 2,5-bis(4-bromofenil)-4-clorooxazol 7 junto con 2,5-bis(4-bromofenil)-4-oxazolidinona 8 . Este último compuesto es en general un subproducto . [6]

Otro ejemplo útil es la síntesis en dos pasos en un solo paso del halcordinol, un compuesto original de los alcaloides de Rutaceae. Los pasos iniciales siguen a la síntesis de oxazol de Fischer, aunque la ciclización catalizada por ácido ocurre en dos pasos en lugar de uno, lo que asegura la formación del intermedio dicloro , evitando la formación del regioisómero . [4]

En investigaciones recientes, [ cita requerida ] una reconsideración de la síntesis de oxazol de Fischer ha llevado a la síntesis de oxazoles 2,5-disustituidos a partir de aldehídos y α-hidroxiamidas. Sin embargo, a diferencia de la síntesis de oxazol de Fischer, el nuevo método no se limita a los diariloxazoles. [7]