La síntesis de indol de Bartoli (también llamada reacción de Bartoli ) es la reacción química de nitroarenos orto-sustituidos y nitroarenos con reactivos de Grignard de vinilo para formar indoles sustituidos . [2] [3] [4] [5]
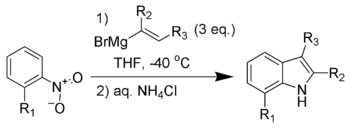
La reacción suele ser infructuosa sin la sustitución orto del grupo nitro, y los sustituyentes orto más voluminosos suelen dar como resultado mayores rendimientos de la reacción. El volumen estérico del grupo orto ayuda a la transposición [3,3]-sigmatrópica necesaria para la formación del producto. Se necesitan tres equivalentes del reactivo de vinilo de Grignard para que la reacción alcance la conversión completa cuando se realiza en nitroarenos, y solo dos equivalentes cuando se realiza en nitrosoarenos.
Este método se ha convertido en una de las rutas más cortas y flexibles para producir indoles 7-sustituidos. [6] [7] La síntesis de indoles de Leimgruber-Batcho brinda una flexibilidad y regioespecificidad similares a los derivados de indoles. Una ventaja de la síntesis de indoles de Bartoli es la capacidad de producir indoles sustituidos tanto en el anillo carbocíclico como en el anillo de pirrol , lo que es difícil de hacer con la síntesis de indoles de Leimgruber-Batcho.
El mecanismo de reacción [8] de la síntesis de indol de Bartoli se ilustra a continuación utilizando o-nitrotolueno ( 1 ) y propenil Grignard ( 2 ) para formar 3,7-dimetilindol ( 13 ).

El mecanismo comienza con la adición del reactivo de Grignard ( 2 ) al nitroareno ( 1 ) para formar el intermedio 3 . El intermedio 3 se descompone espontáneamente para formar un nitrosoareno ( 4 ) y una sal de magnesio ( 5 ). (Tras el tratamiento de la reacción, la sal de magnesio liberará un compuesto carbonílico ( 6 ).) La reacción del nitrosoareno ( 4 ) con un segundo equivalente del reactivo de Grignard ( 2 ) forma el intermedio 7 . El volumen estérico del grupo orto provoca un reordenamiento [3,3]-sigmatrópico que forma el intermedio 8 . La ciclización y la tautomerización dan el intermedio 10 , que reaccionará con un tercer equivalente del reactivo de Grignard ( 2 ) para dar una sal indólica de dimagnesio ( 12 ). El tratamiento de la reacción elimina el agua y da el indol final deseado ( 13 ).
Por lo tanto, son necesarios tres equivalentes del reactivo de Grignard, ya que un equivalente se convierte en el compuesto carbonílico 6 , un equivalente desprotona 10 formando un alqueno ( 11 ), y un equivalente se incorpora al anillo indólico.
El intermedio nitroso ( 4 ) se ha aislado de la reacción. Además, la reacción del intermedio nitroso ( 4 ) con dos equivalentes del reactivo de Grignard produce el indol esperado.
El alcance de la reacción incluye piridinas sustituidas que pueden usarse para producir 4-azaindoles (izquierda) y 6-azaindoles (derecha). [9]
Adrian Dobbs mejoró enormemente el alcance de la síntesis de indol de Bartoli al utilizar un ortobromo como grupo director, que posteriormente es eliminado por AIBN e hidruro de tributilestaño . [10]
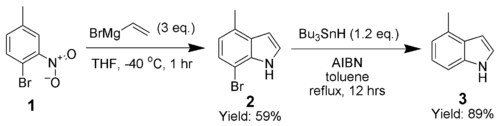
La síntesis de 4-metilindol ( 3 ) resalta la capacidad de esta técnica para producir indoles altamente sustituidos.