
La resonancia magnética nuclear bidimensional (RMN 2D) es una técnica espectroscópica avanzada que aprovecha las capacidades de la RMN unidimensional (1D) al incorporar una dimensión de frecuencia adicional. Esta extensión permite un análisis más completo de las estructuras moleculares. [1] En la RMN 2D, las señales se distribuyen en dos ejes de frecuencia, lo que proporciona una mejor resolución y separación de picos superpuestos, lo que resulta particularmente beneficioso para estudiar moléculas complejas. Esta técnica identifica correlaciones entre diferentes núcleos dentro de una molécula, lo que facilita la determinación de la conectividad, la proximidad espacial y las interacciones dinámicas.
La RMN 2D abarca una variedad de experimentos, [1] incluyendo COSY (espectroscopia de correlación), TOCSY (espectroscopia de correlación total), NOESY (espectroscopia de efecto Overhauser nuclear) y HSQC (coherencia cuántica única heteronuclear). Estas técnicas son indispensables en campos como la biología estructural, donde son fundamentales para determinar las estructuras de proteínas y ácidos nucleicos; la química orgánica, donde ayudan a dilucidar moléculas orgánicas complejas; y la ciencia de los materiales, donde ofrecen información sobre las interacciones moleculares en polímeros y estructuras metalorgánicas. Al resolver señales que normalmente se superpondrían en los espectros de RMN 1D de moléculas complejas, la RMN 2D mejora la claridad de la información estructural. [1] La RMN 2D puede proporcionar información detallada sobre la estructura química y la disposición tridimensional de las moléculas.
El primer experimento bidimensional, COSY, fue propuesto por Jean Jeener , profesor de la Universidad Libre de Bruselas, en 1971. Este experimento fue implementado posteriormente por Walter P. Aue, Enrico Bartholdi y Richard R. Ernst , quienes publicaron su trabajo en 1976. [2] [3] [4]
Cada experimento consiste en una secuencia de pulsos de radiofrecuencia (RF) con períodos de retardo entre ellos. El tiempo, las frecuencias y las intensidades de estos pulsos distinguen entre sí los distintos experimentos de RMN. [5] Casi todos los experimentos bidimensionales tienen cuatro etapas: el período de preparación, en el que se crea una coherencia de magnetización mediante un conjunto de pulsos de RF; el período de evolución, un período de tiempo determinado durante el cual no se emiten pulsos y se permite que los espines nucleares precesen (roten) libremente; el período de mezcla, en el que se manipula la coherencia mediante otra serie de pulsos hasta un estado que dará una señal observable; y el período de detección, en el que se observa la señal de decaimiento por inducción libre de la muestra en función del tiempo, de manera idéntica a la RMN-FT unidimensional. [6]
Las dos dimensiones de un experimento de RMN bidimensional son dos ejes de frecuencia que representan un desplazamiento químico. Cada eje de frecuencia está asociado con una de las dos variables de tiempo, que son la longitud del período de evolución (el tiempo de evolución ) y el tiempo transcurrido durante el período de detección (el tiempo de detección ). Cada uno de ellos se convierte de una serie de tiempo a una serie de frecuencia a través de una transformada de Fourier bidimensional . Un único experimento bidimensional se genera como una serie de experimentos unidimensionales, con un tiempo de evolución específico diferente en experimentos sucesivos, con la duración completa del período de detección registrada en cada experimento. [6]
El resultado final es un gráfico que muestra un valor de intensidad para cada par de variables de frecuencia. Las intensidades de los picos del espectro se pueden representar mediante una tercera dimensión. Lo más habitual es que la intensidad se indique mediante líneas de contorno o distintos colores.
En estos métodos, la transferencia de magnetización ocurre entre núcleos del mismo tipo, a través del acoplamiento J de núcleos conectados por hasta unos pocos enlaces.

El primer y más popular experimento de RMN bidimensional es la secuencia de espectroscopia de correlación homonuclear (COSY), que se utiliza para identificar espines acoplados entre sí. Consiste en un único pulso de RF (p1) seguido del tiempo de evolución específico (t1) seguido de un segundo pulso (p2) seguido de un período de medición (t2). [7]
El experimento de espectroscopia de correlación funciona mediante la correlación de núcleos acoplados entre sí a través de acoplamiento escalar, también conocido como acoplamiento J. [8] Este acoplamiento es la interacción entre espines nucleares conectados por enlaces, que se observa típicamente entre núcleos que están separados por 2 o 3 enlaces (por ejemplo, protones vecinales). Al detectar estas interacciones, COSY proporciona información vital sobre la conectividad entre átomos dentro de una molécula, lo que lo convierte en una herramienta crucial para la elucidación estructural en química orgánica.
El experimento COSY genera un espectro bidimensional con desplazamientos químicos a lo largo del eje x (horizontal) y del eje y (vertical) e implica varios pasos clave. [1] Primero, la muestra se excita utilizando una serie de pulsos de radiofrecuencia (RF), llevando los espines nucleares a un estado de energía más alta . Después del primer pulso de RF, el sistema evoluciona libremente durante un período llamado t 1 , durante el cual los espines precesan a frecuencias correspondientes a sus desplazamientos químicos. La correlación entre núcleos se logra variando incrementalmente el tiempo de evolución (t 1 ) para capturar interacciones indirectas. Esta serie de experimentos, cada uno con un valor diferente de t 1 , permite la detección de desplazamientos químicos de los núcleos que pueden no observarse directamente en un espectro unidimensional. A medida que t 1 se incrementa, se producen picos cruzados en el espectro 2D resultante, que representan interacciones como el acoplamiento o la proximidad espacial entre núcleos. Este enfoque ayuda a trazar conexiones atómicas, proporcionando una visión más profunda de la estructura molecular y ayudando en la interpretación de sistemas complejos.
Los picos cruzados son el resultado de un fenómeno llamado transferencia de magnetización y su presencia indica que dos núcleos están acoplados y tienen dos desplazamientos químicos diferentes que forman las coordenadas del pico cruzado. Cada acoplamiento da lugar a dos picos cruzados simétricos por encima y por debajo de la diagonal. Es decir, se produce un pico cruzado cuando existe una correlación entre las señales del espectro a lo largo de cada uno de los dos ejes en estos valores. Una forma visual sencilla de determinar qué acoplamientos representa un pico cruzado es encontrar el pico diagonal que está directamente por encima o por debajo del pico cruzado y el otro pico diagonal que está directamente a la izquierda o a la derecha del pico cruzado. Los núcleos representados por esos dos picos diagonales están acoplados. [7]
A continuación, se aplica un segundo pulso de RF para permitir que la magnetización se transfiera entre los núcleos acoplados. La señal resultante se registra de forma continua durante un período de detección (t 2 ) después del segundo pulso de RF. A continuación, los datos se procesan mediante la transformación de Fourier a lo largo de los ejes t 1 y t 2 , lo que crea un espectro 2D con picos trazados a lo largo de la diagonal y fuera de la diagonal.
Al interpretar el espectro COSY, los picos diagonales corresponden a los desplazamientos químicos unidimensionales de los núcleos individuales, similares a los picos estándar en un espectro de RMN unidimensional. La característica clave de un espectro COSY es la presencia de picos cruzados, como se muestra en la Figura 1, que indican el acoplamiento entre pares de núcleos. Estos picos cruzados proporcionan información crucial sobre la conectividad dentro de una molécula, mostrando que los dos núcleos están conectados por una pequeña cantidad de enlaces, generalmente dos o tres enlaces.
COSY es especialmente útil cuando se trabaja con moléculas complejas, como productos naturales, péptidos y proteínas, donde es crucial comprender la conectividad de diferentes núcleos a través de enlaces. Si bien la RMN 1D es más sencilla e ideal para identificar características estructurales básicas, COSY mejora las capacidades de la RMN al brindar información más profunda sobre la conectividad molecular.
El espectro bidimensional que resulta del experimento COSY muestra las frecuencias de un solo isótopo , más comúnmente hidrógeno ( 1 H) a lo largo de ambos ejes. (También se han ideado técnicas para generar espectros de correlación heteronuclear, en los que los dos ejes corresponden a diferentes isótopos, como 13 C y 1 H). Los picos diagonales corresponden a los picos en un experimento 1D-NMR, mientras que los picos cruzados indican acoplamientos entre pares de núcleos (de manera muy similar a como la división de multipletes indica acoplamientos en 1D-NMR). [7]

COSY-90 es el experimento COSY más común. En COSY-90, el pulso p1 inclina el espín nuclear en 90°. Otro miembro de la familia COSY es COSY-45 . En COSY-45 se utiliza un pulso de 45° en lugar de un pulso de 90° para el segundo pulso, p2. La ventaja de un COSY-45 es que los picos diagonales son menos pronunciados, lo que hace que sea más sencillo hacer coincidir los picos cruzados cerca de la diagonal en una molécula grande. Además, los signos relativos de las constantes de acoplamiento (ver J-coupling#Magnitud del J-coupling ) se pueden dilucidar a partir de un espectro COSY-45. Esto no es posible utilizando COSY-90. [9] En general, el COSY-45 ofrece un espectro más limpio mientras que el COSY-90 es más sensible.
Otra técnica COSY relacionada es el COSY de doble filtrado cuántico (DQF). El COSY DQF utiliza un método de selección de coherencia como el ciclo de fase o gradientes de campo pulsado , que hacen que solo las señales de coherencias de doble cuántico den una señal observable. Esto tiene el efecto de disminuir la intensidad de los picos diagonales y cambiar su forma de línea de una forma de línea de "dispersión" amplia a una forma de línea de "absorción" más nítida. También elimina los picos diagonales de los núcleos desacoplados. Todos estos tienen la ventaja de que dan un espectro más limpio en el que se evita que los picos diagonales oculten los picos cruzados, que son más débiles en un espectro COSY regular. [10]
El experimento TOCSY es similar al experimento COSY, en el sentido de que se observan picos cruzados de protones acoplados. Sin embargo, los picos cruzados se observan no solo para núcleos que están acoplados directamente, sino también entre núcleos que están conectados por una cadena de acoplamientos. Esto lo hace útil para identificar las redes interconectadas más grandes de acoplamientos de espín. Esta capacidad se logra insertando una serie repetitiva de pulsos que causan una mezcla isotrópica durante el período de mezcla. Los tiempos de mezcla isotrópica más largos hacen que la polarización se extienda a través de un número creciente de enlaces. [11]
En el caso de los oligosacáridos, cada residuo de azúcar es un sistema de espín aislado, por lo que es posible diferenciar todos los protones de un residuo de azúcar específico. También está disponible una versión 1D de TOCSY, y al irradiar un solo protón se puede revelar el resto del sistema de espín. Los avances recientes en esta técnica incluyen el experimento TOCSY 1D-CSSF (filtro selectivo por desplazamiento químico), que produce espectros de mayor calidad y permite extraer de manera confiable las constantes de acoplamiento y usarlas para ayudar a determinar la estereoquímica.
A TOCSY a veces se le denomina "espectroscopia homonuclear Hartmann-Hahn" (HOHAHA). [12]
INADEQUATE [13] es un método que se utiliza a menudo para encontrar acoplamientos de 13 C entre átomos de carbono adyacentes. Debido a que la abundancia natural de 13 C es de solo alrededor del 1 %, solo alrededor del 0,01 % de las moléculas que se estudian tendrán los dos átomos de 13 C cercanos necesarios para una señal en este experimento. Sin embargo, se utilizan métodos de selección de correlación (de manera similar a DQF COSY) para evitar señales de átomos de 13 C individuales, de modo que las señales dobles de 13 C se puedan resolver fácilmente. Cada par de núcleos acoplados da un par de picos en el espectro INADEQUATE que tienen la misma coordenada vertical, que es la suma de los desplazamientos químicos de los núcleos; la coordenada horizontal de cada pico es el desplazamiento químico de cada uno de los núcleos por separado. [14]
La espectroscopia de correlación heteronuclear proporciona una señal basada en el acoplamiento entre núcleos de dos tipos diferentes. A menudo, los dos núcleos son protones y otro núcleo (llamado "heteronúcleo"). Por razones históricas, los experimentos que registran el espectro de protones en lugar del heteronúcleo durante el período de detección se denominan experimentos "inversos". Esto se debe a que la baja abundancia natural de la mayoría de los heteronúcleos daría como resultado que el espectro de protones se viera abrumado por señales de moléculas sin heteronúcleos activos, lo que lo haría inútil para observar las señales acopladas deseadas. Con la llegada de técnicas para suprimir estas señales no deseadas, los experimentos de correlación inversa como HSQC, HMQC y HMBC son en realidad mucho más comunes en la actualidad. La espectroscopia de correlación heteronuclear "normal", en la que se registra el espectro del heteronúcleo, se conoce como HETCOR. [15]
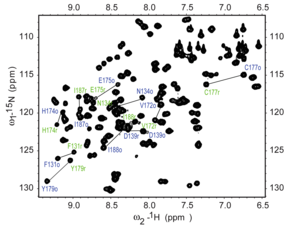
La coherencia cuántica simple heteronuclear (HSQC) es una técnica de RMN 2D utilizada para la detección de interacciones entre diferentes tipos de núcleos que están separados por un enlace, particularmente un protón ( 1H ) y un heteronúcleo como el carbono ( 13C ) o el nitrógeno ( 15N ). [17] Este método proporciona un pico por par de núcleos acoplados, cuyas dos coordenadas son los desplazamientos químicos de los dos átomos acoplados. [18]
Este método desempeña un papel en la elucidación estructural, particularmente en el análisis de compuestos orgánicos, productos naturales y biomoléculas como proteínas y ácidos nucleicos. HSQC está diseñado para detectar correlaciones de un enlace entre protones y átomos heteronucleares, lo que proporciona información sobre la conectividad de hidrógeno y átomos heteronucleares a través de la transferencia de magnetización.
El experimento HSQC implica una serie de pasos para generar un espectro de RMN bidimensional. Inicialmente, la muestra se excita utilizando pulsos de radiofrecuencia (RF), lo que lleva los espines nucleares a un estado excitado y los prepara para la transferencia de magnetización. Luego, la magnetización se transfiere del protón al heteronúcleo a través de un acoplamiento escalar de un enlace (acoplamiento J), lo que garantiza que solo los núcleos directamente enlazados participen en la transferencia. Posteriormente, el sistema evoluciona durante un período llamado t 1 , y la magnetización se transfiere nuevamente del heteronuclear al protón. Se detecta la señal final, que codifica tanto la información del protón como la del heteronuclear, y se realiza una transformación de Fourier para crear un espectro 2D que correlaciona los desplazamientos químicos del protón y el heteronuclear.
El HSQC funciona transfiriendo la magnetización del núcleo I (normalmente el protón) al núcleo S (normalmente el heteroátomo) utilizando la secuencia de pulsos INEPT ; este primer paso se realiza porque el protón tiene una mayor magnetización de equilibrio y, por lo tanto, este paso crea una señal más fuerte. Luego, la magnetización evoluciona y luego se transfiere de nuevo al núcleo I para su observación. Luego, se puede utilizar opcionalmente un paso de eco de espín adicional para desacoplar la señal, simplificando el espectro al colapsar los multipletes en un solo pico. Las señales desacopladas no deseadas se eliminan ejecutando el experimento dos veces con la fase de un pulso específico invertida; esto invierte los signos de los picos deseados pero no de los no deseados, por lo que restar los dos espectros dará solo los picos deseados. [18]
La interpretación del espectro HSQC se basa en la observación de picos cruzados, que indican el enlace directo entre protones y carbonos o nitrógenos. Cada pico cruzado corresponde a un par específico 1 H- 13 C o 1 H- 15 N, lo que proporciona asignaciones directas de conectividad 1H-X, donde X es el heteronúcleo [17]. La técnica HSQC ofrece varias ventajas, incluido su enfoque en correlaciones de un enlace, mayor sensibilidad debido a la detección directa de protones y la simplificación de espectros abarrotados al resolver señales superpuestas y ayudar en el análisis de moléculas complejas.
La espectroscopia de correlación cuántica múltiple heteronuclear (HMQC) proporciona un espectro idéntico al HSQC, pero utilizando un método diferente. Los dos métodos dan resultados de calidad similar para moléculas de tamaño pequeño a mediano, pero se considera que HSQC es superior para moléculas más grandes. [18]
La HMBC detecta correlaciones heteronucleares en rangos más largos de aproximadamente 2 a 4 enlaces. La dificultad de detectar correlaciones de enlaces múltiples es que las secuencias HSQC y HMQC contienen un tiempo de retardo específico entre pulsos que permite la detección solo de un rango alrededor de una constante de acoplamiento específica. Esto no es un problema para los métodos de enlace único ya que las constantes de acoplamiento tienden a estar en un rango estrecho, pero las constantes de acoplamiento de enlaces múltiples cubren un rango mucho más amplio y no se pueden capturar todas en un solo experimento HSQC o HMQC. [19]
En el método HMBC, esta dificultad se supera omitiendo uno de estos retrasos de una secuencia HMQC. Esto aumenta el rango de constantes de acoplamiento que se pueden detectar y también reduce la pérdida de señal por relajación. El costo es que esto elimina la posibilidad de desacoplar el espectro e introduce distorsiones de fase en la señal. Existe una modificación del método HMBC que suprime las señales de un enlace, dejando solo las señales de múltiples enlaces. [19]
Estos métodos establecen correlaciones entre núcleos que se encuentran físicamente próximos entre sí, independientemente de si existe un enlace entre ellos. Utilizan el efecto nuclear Overhauser (NOE), por el cual los átomos cercanos (dentro de unos 5 Å) experimentan una relajación cruzada mediante un mecanismo relacionado con la relajación de espín-red .
En NOESY, la relajación cruzada de Overhauser entre los espines nucleares durante el período de mezcla se utiliza para establecer las correlaciones. El espectro obtenido es similar al COSY, con picos diagonales y picos cruzados, sin embargo, los picos cruzados conectan resonancias de núcleos que están espacialmente cercanos en lugar de aquellos que están acoplados entre sí por enlaces. Los espectros NOESY también contienen picos axiales adicionales que no brindan información adicional y se pueden eliminar mediante un experimento diferente invirtiendo la fase del primer pulso. [20]
Una aplicación de NOESY es el estudio de biomoléculas grandes, como en la RMN de proteínas , en la que las relaciones a menudo se pueden asignar mediante el uso de un recorrido secuencial .
El experimento NOESY también se puede realizar de forma unidimensional mediante la preselección de resonancias individuales. Los espectros se leen con los núcleos preseleccionados que dan una señal grande y negativa, mientras que los núcleos vecinos se identifican mediante señales positivas más débiles. Esto solo revela qué picos tienen NOE mensurables para la resonancia de interés, pero lleva mucho menos tiempo que el experimento 2D completo. Además, si un núcleo preseleccionado cambia de entorno dentro de la escala de tiempo del experimento, se pueden observar múltiples señales negativas. Esto ofrece información de intercambio similar al método de RMN EXSY (espectroscopia de intercambio).
Los experimentos NOESY son una herramienta importante para identificar la estereoquímica de una molécula en un solvente, mientras que la difracción de rayos X de un solo cristal se utiliza para identificar la estereoquímica de una molécula en forma sólida.
En HOESY, se utiliza NOESY para la relajación cruzada entre espines nucleares. Sin embargo, HOESY puede ofrecer información sobre otros núcleos activos de RMN de una manera espacialmente relevante. Los ejemplos incluyen cualquier núcleo X{Y} o X→Y como 1 H→ 13 C, 19 F→ 13 C, 31 P→ 13 C o 77 Se→ 13 C. Los experimentos suelen observar NOE de protones en X, X{ 1 H}, pero no tienen que incluir protones. [21]
El ROESY es similar al NOESY, excepto que el estado inicial es diferente. En lugar de observar la relajación cruzada a partir de un estado inicial de magnetización z , la magnetización de equilibrio se rota sobre el eje x y luego se bloquea mediante un campo magnético externo para que no pueda precesar. Este método es útil para ciertas moléculas cuyo tiempo de correlación rotacional cae en un rango donde el efecto nuclear Overhauser es demasiado débil para ser detectable, generalmente moléculas con un peso molecular de alrededor de 1000 daltons , porque el ROESY tiene una dependencia diferente entre el tiempo de correlación y la constante de tasa de relajación cruzada. En el NOESY, la constante de tasa de relajación cruzada va de positiva a negativa a medida que aumenta el tiempo de correlación, lo que da un rango donde es cercana a cero, mientras que en el ROESY la constante de tasa de relajación cruzada es siempre positiva. [22] [23]
A veces se denomina a ROESY "relajación cruzada apropiada para minimoléculas emuladas por espines bloqueados" (CAMELSPIN). [23]
A diferencia de los espectros correlacionados, los espectros resueltos extienden los picos en un experimento de RMN 1D en dos dimensiones sin agregar picos adicionales. Estos métodos generalmente se denominan espectroscopia resuelta en J, pero a veces también se conocen como espectroscopia resuelta por desplazamiento químico o espectroscopia resuelta en δ. Son útiles para analizar moléculas para las cuales los espectros de RMN 1D contienen multipletes superpuestos, ya que el espectro resuelto en J desplaza verticalmente el multiplete de cada núcleo en una cantidad diferente. Cada pico en el espectro 2D tendrá la misma coordenada horizontal que tiene en un espectro 1D no desacoplado, pero su coordenada vertical será el desplazamiento químico del pico único que tiene el núcleo en un espectro 1D desacoplado. [24]
Para la versión heteronuclear, la secuencia de pulsos más simple utilizada se denomina experimento Müller–Kumar–Ernst (MKE), que tiene un solo pulso de 90° para el heteronúcleo durante el período de preparación, sin período de mezcla, y aplica una señal de desacoplamiento al protón durante el período de detección. Existen varias variantes de esta secuencia de pulsos que son más sensibles y precisas, que se incluyen en las categorías de métodos de desacoplamiento controlado y métodos de inversión de espín . La espectroscopia homonuclear resuelta en J utiliza la secuencia de pulsos de eco de espín . [24]
También se pueden realizar experimentos en 3D y 4D, a veces ejecutando secuencias de pulsos de dos o tres experimentos en 2D en serie. Sin embargo, muchos de los experimentos en 3D que se utilizan habitualmente son experimentos de triple resonancia ; algunos ejemplos incluyen los experimentos HNCA y HNCOCA , que se utilizan a menudo en la RMN de proteínas .