La reparación por escisión de nucleótidos es un mecanismo de reparación del ADN . [2] El daño al ADN ocurre constantemente debido a sustancias químicas (por ejemplo, agentes intercalantes ), radiación y otros mutágenos . Existen tres vías de reparación por escisión para reparar el daño del ADN monocatenario: reparación por escisión de nucleótidos (NER), reparación por escisión de bases (BER) y reparación de desajustes del ADN (MMR). Si bien la vía BER puede reconocer lesiones no voluminosas específicas en el ADN, solo puede corregir bases dañadas que son eliminadas por glicosilasas específicas . De manera similar, la vía MMR solo se dirige a pares de bases Watson-Crick desparejados .
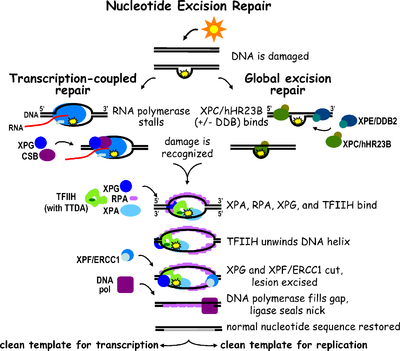
La reparación por escisión de nucleótidos (NER) es un mecanismo de escisión particularmente importante que elimina el daño del ADN inducido por la luz ultravioleta (UV). El daño del ADN por UV da como resultado aductos de ADN voluminosos ; estos aductos son principalmente dímeros de timina y fotoproductos 6,4. El reconocimiento del daño conduce a la eliminación de un segmento corto de ADN monocatenario que contiene la lesión. El ADN monocatenario intacto permanece y la ADN polimerasa lo usa como plantilla para sintetizar una secuencia complementaria corta . La ligadura final para completar la NER y formar un ADN bicatenario se lleva a cabo por la ADN ligasa . La NER se puede dividir en dos subvías: NER genómica global (GG-NER o GGR) y NER acoplada a la transcripción (TC-NER o TCR). Las dos subvías difieren en cómo reconocen el daño del ADN, pero comparten el mismo proceso para la incisión, reparación y ligadura de la lesión.
La importancia de la NER se evidencia en las graves enfermedades humanas que resultan de mutaciones genéticas innatas de las proteínas NER. El xeroderma pigmentoso y el síndrome de Cockayne son dos ejemplos de enfermedades asociadas a la NER.
La reparación por escisión de nucleótidos es más compleja en eucariotas que en procariotas , que expresan enzimas como la fotoliasa . En humanos y otros animales placentarios , hay 9 proteínas principales involucradas en la NER. Las deficiencias en ciertas proteínas conducen a enfermedades; los nombres de las proteínas están asociados con la enfermedad. XPA , XPB , XPC , XPD, XPE , XPF y XPG derivan del хeroderma pigmentosum y CSA y CSB representan proteínas vinculadas al síndrome de Cockayne. Además, las proteínas ERCC1 , RPA , RAD23A , RAD23B y otras también participan en la reparación por escisión de nucleótidos. A continuación, se encuentra una lista más completa de las proteínas involucradas en la NER.
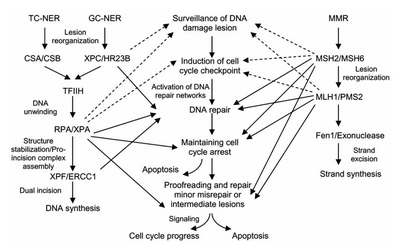
La reparación por escisión de nucleótidos eucariota se puede dividir en dos subvías: NER genómica global (GG-NER) y NER acoplada a la transcripción (TC-NER). Tres conjuntos diferentes de proteínas participan en el reconocimiento del daño del ADN para cada subvía. Después del reconocimiento del daño, las tres subvías convergen para los pasos de doble incisión, reparación y ligadura.
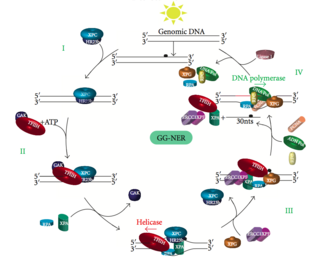
La NER genómica global repara los daños en las cadenas de ADN transcritas y no transcritas en genes activos e inactivos en todo el genoma. Este proceso no depende de la transcripción. Esta vía emplea varias proteínas "detectoras de daños", incluidas las proteínas de unión al daño del ADN (DDB) y los complejos XPC-Rad23B que escanean constantemente el genoma y reconocen las distorsiones de la hélice: el complejo XPC -Rad23B es responsable del reconocimiento de la distorsión, mientras que DDB1 y DDB2 ( XPE ) también pueden reconocer algunos tipos de daños causados por la luz ultravioleta. Además, XPA realiza una función en el reconocimiento de daños que aún no está bien definida. Tras la identificación de un sitio dañado, las proteínas de reparación posteriores se reclutan al ADN dañado para verificar la presencia de daño en el ADN, extirpar el ADN dañado que rodea la lesión y luego rellenar el parche de reparación.
Las mutaciones en la maquinaria GG-NER son responsables de múltiples trastornos genéticos, entre ellos:
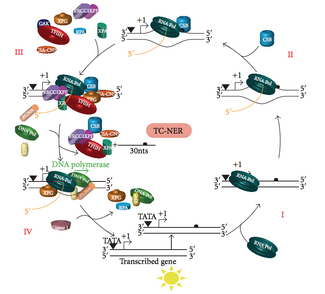
En cualquier momento dado, la mayor parte del genoma de un organismo no está en proceso de transcripción; existe una diferencia en la eficiencia de la NER entre las regiones transcripcionalmente silenciosas y transcripcionalmente activas del genoma. En muchos tipos de lesiones, la NER repara las cadenas transcripcionales de genes transcripcionalmente activos más rápido que las cadenas no transcripcionales y el ADN transcripcionalmente silencioso.
TC-NER y GG-NER difieren únicamente en los pasos iniciales del reconocimiento de daños en el ADN. La principal diferencia entre TC-NER y GG-NER es que TC-NER no requiere proteínas XPC o DDB para el reconocimiento de distorsiones en células de mamíferos. En cambio, TC-NER se inicia cuando la ARN polimerasa se detiene en una lesión en el ADN: la ARN polimerasa bloqueada actúa como señal de reconocimiento de daños, que reemplaza la necesidad de las propiedades de reconocimiento de distorsiones de los complejos XPC-RAD23B y DDB. Las proteínas CS (CSA y CSB) se unen a algunos tipos de daño en el ADN en lugar de XPC-Rad23B.
Son posibles otros mecanismos de reparación, pero menos precisos y eficientes.
La TC-NER se inicia cuando la ARN polimerasa se detiene en una lesión del ADN, tras lo cual los complejos proteínicos ayudan a que la polimerasa retroceda. Las mutaciones en la maquinaria de la TC-NER son responsables de múltiples trastornos genéticos, entre ellos:
El factor de transcripción II H (TFIIH) es la enzima clave involucrada en la escisión dual. TFIIH y XPG son reclutados primero al sitio del daño del ADN (XPG estabiliza TFIIH). Las subunidades TFIIH de XPD y XPB actúan como una helicasa 5'-3' y 3'-5', respectivamente: ayudan a desenrollar el ADN y generan una unión entre el ADN bicatenario y monocatenario alrededor de la burbuja de transcripción . Además de estabilizar TFIIH, XPG también tiene actividad endonucleasa ; corta el daño del ADN en el lado 3' mientras que la proteína heterodímera XPF - ERCC1 corta en el lado 5'. La incisión dual conduce a la eliminación de un ssDNA con un espacio de cadena simple de 25~30 nucleótidos. Los oligonucleótidos de ADN pequeños, extirpados y que contienen el daño (sedDNA) se liberan inicialmente del dúplex en un complejo con TFIIH, pero luego se disocian de manera dependiente de ATP y se unen a la proteína de replicación A (RPA). La inhibición de la síntesis y ligación del ADN que rellena los huecos da como resultado una acumulación de sedDNA unidos a la RPA en la célula.
La proteína de replicación A (RPA) y la proteína XPA son las dos últimas proteínas asociadas con el complejo principal de reparación de NER. Estas dos proteínas están presentes antes de la unión de TFIIH, ya que participan en la verificación del daño del ADN. También pueden proteger el ADN monocatenario. Después de la verificación, se realiza la incisión del lado 5' y la reparación del ADN comienza antes de la incisión del lado 3'. Esto ayuda a reducir el ADN monocatenario expuesto durante el proceso de reparación.
El factor de replicación C ( RFC ) carga el antígeno nuclear de células proliferantes (PCNA) en la cadena de ADN. Esto permite que las ADN polimerasas implicadas en la reparación (δ, ε y/o κ) copien la cadena no dañada mediante translocación. La ADN ligasa I y la endonucleasa Flap 1 o el complejo Ligasa-III-XRCC1 sellan las muescas para completar la NER.

El proceso de reparación por escisión de nucleótidos está controlado en Escherichia coli por el complejo enzimático de endonucleasa UvrABC , que consta de cuatro proteínas Uvr: UvrA, UvrB, UvrC y la helicasa II de ADN (a veces también conocida como UvrD en este complejo). Primero, un complejo UvrA-UvrB escanea el ADN, y la subunidad UvrA reconoce distorsiones en la hélice, causadas, por ejemplo, por dímeros de pirimidina . Cuando el complejo reconoce dicha distorsión, la subunidad UvrA sale y entra una proteína UvrC y se une al monómero UvrB y, por lo tanto, forma un nuevo dímero UvrBC . UvrB escinde un enlace fosfodiéster 4 nucleótidos aguas abajo del daño del ADN, y UvrC escinde un enlace fosfodiéster 8 nucleótidos aguas arriba del daño del ADN y crea un segmento escindido de 12 nucleótidos. La helicasa II del ADN (a veces llamada UvrD) entra entonces en acción y elimina el segmento escindido rompiendo activamente los enlaces de hidrógeno entre las bases complementarias. El hueco resultante se rellena luego utilizando la ADN polimerasa I y la ADN ligasa. El proceso básico de escisión es muy similar en las células superiores, pero estas células suelen implicar muchas más proteínas; E. coli es un ejemplo sencillo. [5]
La TC-NER también existe en bacterias y está mediada por la proteína TRCF (Mfd) . TRCF es una ATPasa SF2 que utiliza la hidrólisis de ATP para translocar en dsADN aguas arriba de la burbuja de transcripción y translocar hacia adelante la ARN polimerasa, iniciando así la disociación del complejo de elongación ternario de la ARN polimerasa. TRCF también recluta la maquinaria de reparación por escisión de nucleótidos Uvr(A)BC mediante interacción física directa con la subunidad UvrA.
Aunque los estudios históricos han mostrado resultados inconsistentes, la variación genética o mutación en los genes de reparación por escisión de nucleótidos puede afectar el riesgo de cáncer al afectar la eficacia de la reparación. Los polimorfismos de un solo nucleótido (SNP) y los SNP codificantes no sinónimos (nsSNP) están presentes en niveles muy bajos (>1%) en la población humana. [7] Si se encuentran en genes NER o secuencias reguladoras, dichas mutaciones pueden afectar negativamente la capacidad de reparación del ADN, lo que resulta en un aumento de la probabilidad de desarrollo de cáncer. Si bien no se ha caracterizado el impacto funcional de todos los polimorfismos, algunos polimorfismos en los genes de reparación del ADN o sus secuencias reguladoras inducen cambios fenotípicos y están involucrados en el desarrollo del cáncer. [8] Un estudio de casos de cáncer de pulmón encontró una asociación modesta entre los polimorfismos de SNP específicos de NER y el riesgo de cáncer de pulmón. [9] Los resultados indican que algunas variaciones polimórficas heredadas en los genes NER pueden resultar en predisposición al cáncer de pulmón y potencialmente a otros estados de cáncer.
Dos genes importantes en la vía NER para los cuales el polimorfismo ha mostrado un impacto funcional y fenotípico son los genes XPD y XPC . [10] XPD, también conocido como ERCC2, sirve para abrir el ADN alrededor del sitio del daño durante NER, además de otras actividades transcripcionales. Los estudios han demostrado que los polimorfismos en el exón 10 (G>A)(Asp312Asn) y el exón 23 (A>T)(Lys751Gln) están vinculados con la predisposición genética a varios tipos de cáncer. [11] [12] El gen XPC es responsable de una proteína que reconoce el ADN durante la parte temprana de la vía NER. Este gen puede tener polimorfismos en el intrón 9 y SNP en el exón 15 que también se han correlacionado con el riesgo de cáncer. Las investigaciones han demostrado que un polimorfismo de inserción/deleción de poli (AT) bialélico en el intrón 9 de XPC está asociado con un mayor riesgo de cáncer de piel, mama y próstata, [12] [13] [14] especialmente en las poblaciones del norte de la India.
El estudio de un cáncer hereditario, el xeroderma pigmentoso, ha ayudado a identificar varios genes que codifican proteínas en la vía NER, dos de los cuales son XPC y XPD. XP es causado por una deficiencia homocigótica en la reparación del daño del ADN por UV (GG-NER) que aumenta el riesgo de cáncer de piel de los pacientes en 1000 veces. En pacientes heterocigotos, el riesgo de cáncer es esporádico, pero se puede predecir en función de la evaluación analítica de polimorfismos en genes de reparación del ADN relacionados con XP purificados a partir de linfocitos . [15] En un estudio de las tasas de recaída de cánceres colorrectales de alto riesgo en estadio II y III, el polimorfismo XPD (ERCC2) 2251A>C se correlacionó significativamente con la recaída temprana después del tratamiento quimioterapéutico. [16] Los estudios han indicado que los efectos de los genes NER polimórficos son aditivos, a mayor frecuencia de variantes, mayor riesgo de cáncer. [15] [16] [17]
En humanos y ratones, la mutación de la línea germinal en genes empleados en NER causa características de envejecimiento prematuro. Estos genes y sus proteínas correspondientes incluyen ERCC1 ( ERCC1 ), ERCC2 (XPD), ERCC3 ( XPB ), ERCC4 (XPF), ERCC5 (XPG), ERCC6 (CSB) y ERCC8 (CSA).
Los ratones mutantes ERCC1 deficientes en la reparación del ADN muestran características de envejecimiento acelerado y tienen una vida útil limitada. [18] El envejecimiento acelerado en el mutante afecta a numerosos órganos.
Las mutaciones en el gen ERCC2 (XPD) pueden conducir a varios síndromes, ya sea xeroderma pigmentoso (XP), tricotiodistrofia (TTD) o una combinación de XP y TTD (XPTTD), o una combinación de XP y síndrome de Cockayne (XPCS). [19] TTD y CS ambos muestran características de envejecimiento prematuro. Estas características pueden incluir sordera neurosensorial , degeneración de la retina, hipometilación de la sustancia blanca, calcificación del sistema nervioso central, estatura reducida y caquexia (pérdida de tejido graso subcutáneo). [19] [20] Los fibroblastos XPCS y TTD de humanos y ratones mutantes ERCC2 (XPD) muestran evidencia de reparación defectuosa de daños oxidativos del ADN que pueden subyacer a los síntomas progeroides segmentarios (envejecimiento prematuro) [21] (ver teoría del daño del ADN del envejecimiento ).
Las mutaciones en el gen ERCC3 (XPB) pueden provocar, en humanos, xeroderma pigmentoso (XP) o XP combinado con síndrome de Cockayne (XPCS). [22]
La deficiencia de ERCC4 (XPF) en humanos produce una variedad de afecciones, incluido el envejecimiento acelerado. [23]
En los seres humanos, los defectos mutacionales en el gen ERCC5 (XPG) pueden causar la afección propensa al cáncer xeroderma pigmentoso (XP) solo o en combinación con el trastorno grave del desarrollo neurológico síndrome de Cockayne (SC) o el síndrome cerebro-óculo-facio-esquelético infantil letal. [24] Un modelo de ratón mutante ERCC5 (XPG) presenta características de envejecimiento prematuro que incluyen caquexia y osteoporosis con fenotipos degenerativos pronunciados tanto en el hígado como en el cerebro. [24] Estos ratones mutantes desarrollan un fenotipo degenerativo de envejecimiento prematuro multisistémico que parece fortalecer el vínculo entre el daño del ADN y el envejecimiento . [24] (ver teoría del daño del ADN del envejecimiento ).
El síndrome de Cockayne (SC) surge de mutaciones de la línea germinal en cualquiera de los dos genes ERCC8 (CSA) o ERCC6 (CSB). Las mutaciones de ERCC8 (CSA) generalmente dan lugar a una forma más moderada de SC que las mutaciones de ERCC6 (CSB). [25] Las mutaciones en el gen CSA representan alrededor del 20% de los casos de SC. [26] Los individuos con CSA y CSB se caracterizan por un crecimiento posnatal grave y retraso mental y envejecimiento acelerado que conduce a una muerte prematura a la edad de 12 a 16 años. [27]
Como analizaron Gorbunova et al. [28], los estudios de NER en diferentes células y tejidos de individuos jóvenes y mayores han demostrado con frecuencia una disminución de la capacidad de NER con el aumento de la edad. Esta disminución puede deberse a niveles constitutivos reducidos de proteínas empleadas en la vía de NER. [29]