La transposición del ácido bencílico es formalmente la transposición 1,2 de las 1,2 - dicetonas para formar ácidos α- hidroxi - carboxílicos usando una base . Esta reacción recibe su nombre de la reacción del bencilo con hidróxido de potasio para formar ácido bencílico . Realizada por primera vez por Justus von Liebig en 1838, [1] es el primer ejemplo reportado de una reacción de transposición . [2] Se ha convertido en una reacción clásica en la síntesis orgánica y ha sido revisada muchas veces antes. [3] [4] [5] Puede verse como una reacción redox intramolecular , ya que un centro de carbono se oxida mientras que el otro se reduce.
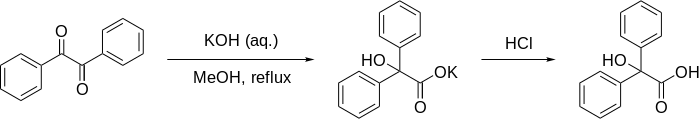
Se ha demostrado que la reacción funciona en sustratos aromáticos , semiaromáticos, alifáticos y heterocíclicos . La reacción funciona mejor cuando los grupos funcionales de cetona no tienen protones enolizables adyacentes , ya que esto permite que la condensación aldólica compita. La reacción es formalmente una contracción de anillo cuando se utiliza en dicetonas cíclicas. Se ha descubierto que los grupos arilo migran más fácilmente que los grupos alquilo, y que los grupos arilo con grupos atractores de electrones migran más rápido.
La reacción es representativa de los reordenamientos 1,2. El mecanismo de reacción, establecido desde hace mucho tiempo , fue propuesto por primera vez en su totalidad por Christopher Kelk Ingold y se ha actualizado con datos in silico [6] como se describe a continuación. La reacción es de segundo orden en términos generales en términos de velocidad, siendo de primer orden en dicetona y de primer orden en base.
Un anión hidróxido ataca a uno de los grupos cetona en 1 en una adición nucleofílica para formar el alcóxido 2. El siguiente paso requiere una rotación de enlace al confórmero 3 que coloca al grupo migratorio R en posición para atacar al segundo grupo carbonilo. En un paso concertado , el grupo R migratorio ataca al grupo α-carbonilo formando otro alcóxido con la formación concomitante de un grupo ceto en el otro carbono. Este paso de migración es determinante de la velocidad . Esta secuencia se asemeja a una sustitución nucleofílica de acilo . Los cálculos muestran que cuando R es metilo, la acumulación de carga en este grupo en el estado de transición puede ser tan alta como 0,22, y que el grupo metilo está posicionado entre el enlace carbono-carbono central.

El ácido carboxílico en el intermedio 4 es menos básico que el alcóxido y, por lo tanto, se produce una transferencia reversible de protones que favorece al intermedio 5 , que se protona en el tratamiento ácido hasta el ácido α - hidroxi - carboxílico final 6. Los cálculos muestran que es posible una descripción precisa de la secuencia de reacción con la participación de 4 moléculas de agua que se encargan de la estabilización de la acumulación de carga. También proporcionan una lanzadera para la transferencia eficiente de un protón en la formación del intermedio 5 .
El mecanismo anterior es consistente con toda la evidencia experimental disponible. [3] El equilibrio entre las especies 1 y 2 está respaldado por experimentos de etiquetado isotópico de 18 O. En agua deuterada , el intercambio de oxígeno carbonílico ocurre mucho más rápido que la reorganización, lo que indica que el primer equilibrio no es el paso determinante de la velocidad. Experimentos posteriores mostraron una velocidad relativa mayor en un sistema de disolvente deuterado en comparación con un sistema de disolvente no deuterado de composición idéntica. Esto se explicó como debido a la mayor basicidad relativa del anión hidróxido deuterado en comparación con el anión hidróxido normal, y se utilizó para indicar que la migración de hidrógeno no ocurrió en el paso determinante de la velocidad de la reacción. Esto descartó un mecanismo concertado para la reacción, ya que la transferencia de hidrógeno ocurriría en el paso determinante de la velocidad.
Esta reacción es idéntica a la transposición normal del ácido bencílico, excepto que se utiliza un alcóxido o un anión amida en lugar de un ion hidróxido. El alcóxido utilizado no debe ser fácilmente oxidable (como el etóxido de potasio ), ya que esto favorece la vía de reducción de Meerwein-Ponndorf-Verley como reacción secundaria. La reacción es de segundo orden en términos de velocidad, siendo de primer orden en términos de alcóxido y de primer orden en términos de dicetona. El producto de la reacción es un α - hidroxiéster o una α- hidroxiamida .
La transposición alfa-cetol es una interconversión de un hidroxilo alfa a un carbonilo a los grupos carbonilo e hidroxilo complementarios, con migración de un sustituyente. Es mecánicamente equivalente a la transposición del ácido bencílico en el punto después de que el nucleófilo ataca al 1,2-dicarbonilo. Se sabe que esta variación de la reacción ocurre en muchos sustratos que tienen el grupo funcional aciloína . La siguiente imagen muestra la expansión del anillo de un ciclopentano a un anillo de ciclohexano como un ejemplo de reacción. [7] [8]