
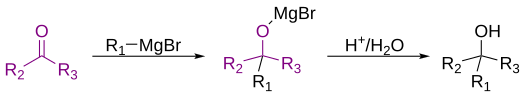
La reacción de Grignard ( en francés: [ɡʁiɲaʁ] ) es una reacción química organometálica en la que, según la definición clásica, se añaden haluros de alquilo , alilo , vinilo o arilo de carbono ( reactivo de Grignard ) a los grupos carbonilo de un aldehído o una cetona en condiciones anhidras. [1] [2] [3] Esta reacción es importante para la formación de enlaces carbono-carbono . [4] [5]
Las reacciones y reactivos de Grignard fueron descubiertos por el químico francés François Auguste Victor Grignard ( Universidad de Nancy , Francia), quien los describió en 1900 y recibió su nombre en honor a él . [6] Recibió el Premio Nobel de Química en 1912 por este trabajo. [7]
La reacción de un haluro orgánico con magnesio no es una reacción de Grignard, sino que proporciona un reactivo de Grignard. [8]

Clásicamente, la reacción de Grignard se refiere a la reacción entre un grupo cetona o aldehído con un reactivo de Grignard para formar un alcohol primario o terciario. [1] Sin embargo, algunos químicos entienden que la definición significa todas las reacciones de cualquier electrófilo con reactivos de Grignard. [9] Por lo tanto, existe cierta disputa sobre la definición moderna de la reacción de Grignard. En el Merck Index , publicado en línea por la Royal Society of Chemistry , se reconoce la definición clásica, seguida de "Una interpretación más moderna extiende el alcance de la reacción para incluir la adición de reactivos de Grignard a una amplia variedad de sustratos electrófilos". [9] Esta variedad de definiciones ilustra que existe cierta disputa dentro de la comunidad química sobre la definición de una reacción de Grignard.
A continuación se muestran algunas reacciones que involucran reactivos de Grignard , pero que en sí mismas no se entienden clásicamente como reacciones de Grignard.

Debido a que el carbono es más electronegativo que el magnesio, el carbono unido al magnesio actúa como un nucleófilo y ataca al átomo de carbono electrofílico en el enlace polar de un grupo carbonilo. La adición del reactivo de Grignard al grupo carbonilo generalmente se produce a través de un estado de transición de anillo de seis miembros , como se muestra a continuación. [10]

Basándose en la detección de productos secundarios de acoplamiento de radicales, también se ha propuesto un mecanismo alternativo de transferencia de un solo electrón (SET) que implica la formación inicial de un radical intermedio cetilo. [11] Un estudio computacional reciente sugiere que el mecanismo operativo (polar vs. radical) depende del sustrato, y que el potencial de reducción del compuesto carbonílico sirve como parámetro clave. [12]

La reacción de Grignard se lleva a cabo en condiciones anhidras . [3] De lo contrario, la reacción fallará porque el reactivo de Grignard actuará como una base en lugar de un nucleófilo y recogerá un protón lábil en lugar de atacar el sitio electrofílico. Esto dará como resultado que no se forme el producto deseado, ya que el grupo R del reactivo de Grignard se protonará mientras que la porción MgX estabilizará las especies desprotonadas.
Para evitar esto, las reacciones de Grignard se completan en una atmósfera inerte para eliminar toda el agua del matraz de reacción y garantizar que se forme el producto deseado. [13] Además, si hay protones ácidos en el material de partida, como se muestra en la figura de la derecha, se puede superar esto protegiendo el sitio ácido del reactivo convirtiéndolo en un éter o un éter sililo para eliminar el protón lábil de la solución antes de la reacción de Grignard.
Se han descubierto otras variaciones del reactivo de Grignard para mejorar la quimioselectividad de la reacción de Grignard, que incluyen, entre otras: Turbo-Grignards, reactivos de organocerio y reactivos de organocuprato (Gilman).
Los reactivos Turbo-Grignard son reactivos de Grignard modificados con cloruro de litio . En comparación con los reactivos de Grignard convencionales, los reactivos Turbo-Grignard son más quimioselectivos ; los ésteres , amidas y nitrilos no reaccionan con el reactivo Turbo-Grignard. [14]


El comportamiento de los reactivos de Grignard puede modificarse de forma útil en presencia de otros metales. Las sales de cobre (I) dan organocupratos que efectúan preferentemente adiciones 1,4 . [15] El tricloruro de cerio permite adiciones 1,2 selectivas a los mismos sustratos. Los haluros de níquel y paladio catalizan reacciones de acoplamiento cruzado .