La reacción de Wohl-Ziegler [1] [2]
es una reacción química que implica la bromación alílica o bencílica de hidrocarburos utilizando una N -bromosuccinimida y un iniciador radical . [3]

Los mejores rendimientos se obtienen con N -bromosuccinimida en disolvente de tetracloruro de carbono . Se han publicado varias revisiones. [4] [5]
En una configuración típica, se añade una cantidad estequiométrica de solución de N -bromosuccinimida y una pequeña cantidad de iniciador a una solución del sustrato en CCl4 , y la mezcla de reacción se agita y se calienta hasta el punto de ebullición. El inicio de la reacción se indica mediante una ebullición más vigorosa; a veces puede ser necesario eliminar la fuente de calor. Una vez que toda la N -bromosuccinimida (que es más densa que el disolvente) se ha convertido en succinimida (que flota en la parte superior), la reacción ha finalizado. Debido a la alta toxicidad y la naturaleza destructora de la capa de ozono del tetracloruro de carbono, se ha propuesto el trifluorotolueno como un disolvente alternativo adecuado para la bromación de Wohl-Ziegler. [6]
La reacción de cloración correspondiente generalmente no se puede lograr con N- clorosuccinimida, [7] aunque se han desarrollado reactivos más especializados, [8] y la reacción se puede lograr industrialmente con gas cloro. [9]
Mecanismo
El mecanismo por el cual se lleva a cabo la reacción de Wohl-Ziegler fue propuesto por Paul Goldfinger en 1953, y su mecanismo de reacción es una de las dos vías propuestas a través de las cuales ocurre la bromación alifática, alílica y bencílica con N -bromosuccinimida (NBS). [10] Se ha demostrado que el mecanismo de Goldfinger es el mecanismo adecuado en oposición al mecanismo previamente aceptado propuesto por George Bloomfield, que, aunque consistente durante los estudios de selectividad, resultó ser demasiado simplista. [10]
Se ha demostrado que la generación de radicales NBS representada en el mecanismo de Bloomfield es mucho más difícil de lo imaginado cuando se propuso, por lo que ha fallado como modelo adecuado a lo largo de los años; sin embargo, la evidencia sugiere que el mecanismo de Bloomfield todavía es aceptable para la oxidación de alcoholes usando NBS. [10] En el mecanismo de Goldfinger, el propósito del NBS es simplemente mantener una concentración muy baja de bromo molecular, mientras que en el mecanismo de Bloomfield, su propósito es la generación del radical inicial utilizado en la reacción, [11] que nuevamente puede ser un proceso bastante difícil. [12] Esto se debe a que requiere una consideración especial para el comportamiento del radical NBS; la única forma en que posiblemente pueda funcionar como se propone en el mecanismo de Bloomfield es si la energía de disociación para el enlace N-Br en NBS es menor que la de Br 2 , y se ha visto mucha evidencia que sugiere un comportamiento contrario. [12] [13] El mecanismo propuesto por Goldfinger no requiere ninguna consideración especial, ya que todas las especies radicales se comportan normalmente, y es en parte debido a esto que su mecanismo se considera correcto. [12]
 [10]
[10]
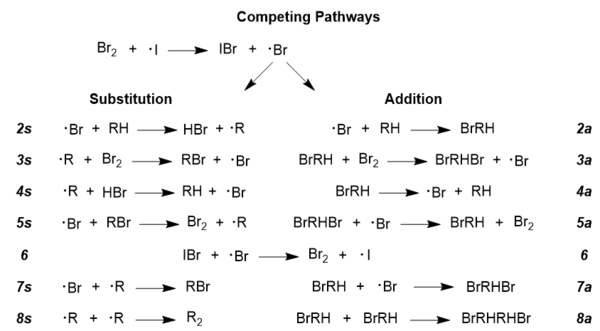
Para explorar más a fondo el mecanismo de reacción aceptado, debe entenderse que existen vías radicales que compiten en cualquier reacción radical; es lo mismo en este caso, ya que las vías de adición y sustitución compiten. [14] Lograr el producto bromado deseado requiere que la vía de sustitución sea dominante, y las condiciones de reacción pueden de hecho manipularse para promover esta vía sobre la vía de adición menos deseable. [13] A continuación se muestran las dos vías en su totalidad; hay reacciones secundarias incluidas en esta figura para completar, como los pasos 6 y 8; estas vías son generales para casi todas las reacciones radicales, por lo que NBS no se muestra aquí, pero su papel se discutirá a continuación.
 [13]
[13]- El papel del NBS en el mecanismo de Goldfinger es promover la regeneración del bromo molecular, [10] pero uno de los beneficios adicionales de usar NBS es que mantiene una baja concentración de bromo molecular, lo cual es clave para promover la sustitución en lugar de la adición. [13] Se han desarrollado leyes de velocidad que describen el comportamiento competitivo de esta reacción, y muestran una fuerte dependencia de la concentración de bromo molecular; a continuación se presentan las dos ecuaciones: una para altas concentraciones de bromo y otra para bajas concentraciones de bromo. [13]
- Concentraciones altas de bromo: r(a/s) = k 2a /k 2s (1 + k 4a /k 3a [Br 2 ]) donde r(a/s) es la relación entre adición y sustitución, y los valores k corresponden a constantes que describen los pasos de reacción específicos ilustrados arriba en Vías competitivas. [13]
- Concentraciones bajas de bromo: r(a/s) = k 2a k 3a [Br 2 ]/k 2s k 4a donde los términos tienen la misma definición que en la ecuación anterior. [13] Se puede observar que en la ecuación para concentraciones bajas de bromo, la relación de adición a sustitución es directamente proporcional a la concentración de bromo molecular, por lo que reducir la concentración de bromo inhibiría la vía de adición y promovería un mayor grado de formación de producto bromado. [13]
Véase también
Referencias
- ^ Alfred Wohl (1919). "Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge". Berichte der deutschen chemischen Gesellschaft . 52 : 51–63. doi :10.1002/cber.19190520109.
- ^ Ziegler, K. , G. Schenck, EW Krockow, A. Siebert, A. Wenz, H. Weber (1942). "Die Synthese des Cantharidins". Los Annalen der Chemie de Justus Liebig . 551 : 1–79. doi :10.1002/jlac.19425510102.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Greenwood, FL; Kellert, MD; Sedlak, J. (1963). "4-Bromo-2-hepteno". Síntesis orgánicas; Volúmenes recopilados , vol. 4, pág. 108.
- ^ C. Djerassi (1948). "Brominaciones con N-bromosuccinimida y compuestos relacionados. La reacción de Wohl-Ziegler". Chem. Rev. 43 (2): 271–317. doi :10.1021/cr60135a004. PMID 18887958.
- ^ Horner, L; Winkelman, EM (1959). "Neuere Methoden der präparativen organischen Chemie II 14. N-Bromsuccinimid, Eigenschaften und Reaktionsweisen Studien zum Ablauf der Substitution XV". Angélica. Química. 71 (11): 349. Código bibliográfico : 1959AngCh..71..349H. doi : 10.1002/ange.19590711102.
- ^ Suarez, Diana; Laval, Gilles; Tu, Shang-Min; Jiang, Dong; Robinson, Claire L.; Scott, Richard; Golding, Bernard T. (junio de 2009). "Bromaciones bencílicas con N-bromosuccinimida en (trifluorometil)benceno". Síntesis . 2009 (11): 1807–1810. doi :10.1055/s-0029-1216793. ISSN 1437-210X.
- ^ Djerassi, Carl. (1948-10-01). "Brominaciones con N-bromosuccinimida y compuestos relacionados. La reacción de Wohl-Ziegler". Chemical Reviews . 43 (2): 271–317. doi :10.1021/cr60135a004. ISSN 0009-2665. PMID 18887958.
- ^ Theilacker, Walter; Wessel, Heinz (1967). "Olefinreaktionen, I. Chlorierung in Allyl-Stellung". Justus Liebigs Annalen der Chemie (en alemán). 703 (1): 34–36. doi :10.1002/jlac.19677030105. ISSN 1099-0690.
- ^ Krähling, Ludger; Krey, Jürgen; Jakobson, Gerald; Grolig, Johann; Miksche, Leopold (2000), "Compuestos alílicos", Ullmann's Encyclopedia of Industrial Chemistry , Sociedad Estadounidense del Cáncer, doi :10.1002/14356007.a01_425, ISBN 9783527306732
- ^ abcde Incremona, JH; Martin, JC (1970). "N-Bromosuccinimida. Mecanismos de bromación alílica y reacciones relacionadas". J. Am. Chem. Soc . 92 (3): 627–634. doi :10.1021/ja00706a034.
- ^ Bloomfield, GF (1944). "Caucho, poliisoprenos y compuestos afines. Parte VI. El mecanismo de las reacciones de sustitución de halógenos y la halogenación aditiva del caucho y el dihidromirceno". J. Am. Chem. Soc. : 114–120. doi :10.1039/JR9440000114.
- ^ abc Nonhebel, DC; Walton, JC (1974). Química de radicales libres: estructura y mecanismo . Londres: Cambridge University Press. págs. 191-193. ISBN 978-0521201490.
- ^ abcdefgh Adam, J.; Gosselain, PA; Goldfinger, P. (1953). "Leyes de adición y sustitución en reacciones atómicas de halógenos". Nature . 171 (4355): 704–705. Bibcode :1953Natur.171..704A. doi :10.1038/171704b0. S2CID 4285312.
- ^ Neuman, RC (1992). Química orgánica . En línea: Robert C. Neuman, Jr.
 [13]
[13]