El agotamiento del ozono consiste en dos eventos relacionados que se han observado desde finales de los años 1970: una reducción constante de alrededor del cuatro por ciento en la cantidad total de ozono en la atmósfera de la Tierra , [ cita requerida ] y una disminución mucho mayor en primavera del ozono estratosférico (la capa de ozono ) alrededor de las regiones polares de la Tierra. [1] Este último fenómeno se conoce como el agujero de ozono. También hay eventos de agotamiento del ozono troposférico polar en primavera , además de estos eventos estratosféricos.
Las principales causas del agotamiento del ozono y del agujero de ozono son los productos químicos manufacturados, especialmente los refrigerantes , disolventes , propelentes y agentes espumantes fabricados con halocarbonos ( clorofluorocarbonos (CFC), HCFC, halones ), denominados sustancias que agotan la capa de ozono (SAO). [2] Estos compuestos son transportados a la estratosfera mediante una mezcla turbulenta después de ser emitidos desde la superficie, mezclándose mucho más rápido de lo que las moléculas pueden asentarse. [3] Una vez en la estratosfera, liberan átomos del grupo halógeno a través de la fotodisociación , que catalizan la descomposición del ozono (O 3 ) en oxígeno (O 2 ). [4] Se observó que ambos tipos de agotamiento del ozono aumentaban a medida que aumentaban las emisiones de halocarbonos.
La disminución de la capa de ozono y el agujero de ozono han generado preocupación mundial por el aumento de los riesgos de cáncer y otros efectos negativos. La capa de ozono impide que las longitudes de onda dañinas de la luz ultravioleta (UVB) pasen a través de la atmósfera de la Tierra . Estas longitudes de onda causan cáncer de piel , quemaduras solares , ceguera permanente y cataratas , [5] que se proyectaba que aumentarían drásticamente como resultado del adelgazamiento del ozono, además de dañar a las plantas y los animales. Estas preocupaciones llevaron a la adopción del Protocolo de Montreal en 1987, que prohíbe la producción de CFC, halones y otros productos químicos que agotan la capa de ozono. [6] Con el tiempo, los científicos han desarrollado nuevos refrigerantes con un potencial de calentamiento global (GWP) más bajo para reemplazar a los más antiguos. Por ejemplo, en los automóviles nuevos, los sistemas R-1234yf son ahora comunes, y se los elige en lugar de refrigerantes con un GWP mucho más alto, como el R-134a y el R-12 .
La prohibición entró en vigor en 1989. Los niveles de ozono se estabilizaron a mediados de la década de 1990 y comenzaron a recuperarse en la década de 2000, ya que el desplazamiento de la corriente en chorro en el hemisferio sur hacia el polo sur se ha detenido e incluso podría estar revirtiéndose. [7] Se proyectó que la recuperación continuaría durante el próximo siglo, y se esperaba que el agujero de ozono alcanzara los niveles anteriores a 1980 alrededor de 2075. [8] En 2019, la NASA informó que el agujero de ozono era el más pequeño desde que se descubrió por primera vez en 1982. [9] [10] La ONU ahora proyecta que, con las regulaciones actuales, la capa de ozono se regenerará completamente para 2045. [11] [12] El Protocolo de Montreal se considera el acuerdo ambiental internacional más exitoso hasta la fecha. [13] [14]
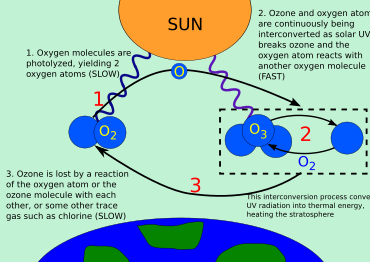
En el ciclo ozono-oxígeno intervienen tres formas (o alótropos ) de oxígeno : átomos de oxígeno (O u oxígeno atómico), gas oxígeno ( O
2o oxígeno diatómico) y gas ozono ( O
3o oxígeno triatómico). [15] El ozono se forma en la estratosfera cuando las moléculas de gas oxígeno se fotodisocian después de absorber fotones UVC. Esto convierte un solo O
2en dos radicales atómicos de oxígeno . Los radicales atómicos de oxígeno luego se combinan con O separados
2moléculas para crear dos O
3Moléculas de ozono. Estas moléculas de ozono absorben la luz UVB, tras lo cual el ozono se divide en una molécula de O
2y un átomo de oxígeno. El átomo de oxígeno se une a una molécula de oxígeno para regenerar ozono. Este es un proceso continuo que termina cuando un átomo de oxígeno se recombina con una molécula de ozono para formar dos átomos de O
2moléculas. Vale la pena señalar que el ozono es el único gas atmosférico que absorbe la luz UVB.

La cantidad total de ozono en la estratosfera está determinada por un equilibrio entre la producción fotoquímica y la recombinación.
El ozono puede ser destruido por una serie de catalizadores de radicales libres ; los más importantes son el radical hidroxilo (OH·), el radical óxido nítrico (NO·), el radical cloro (Cl·) y el radical bromo (Br·). El punto es una notación para indicar que cada especie tiene un electrón desapareado y, por lo tanto, es extremadamente reactiva. Todos estos tienen fuentes tanto naturales como artificiales; en la actualidad, la mayor parte del OH· y NO· en la estratosfera se produce de forma natural, pero la actividad humana ha aumentado drásticamente los niveles de cloro y bromo. [16] Estos elementos se encuentran en compuestos orgánicos estables, especialmente clorofluorocarbonos , que pueden viajar a la estratosfera sin destruirse en la troposfera debido a su baja reactividad. Una vez en la estratosfera, los átomos de Cl y Br se liberan de los compuestos originales por la acción de la luz ultravioleta, por ejemplo.
El ozono es una molécula altamente reactiva que se reduce fácilmente a la forma más estable de oxígeno con la ayuda de un catalizador. Los átomos de Cl y Br destruyen las moléculas de ozono a través de una variedad de ciclos catalíticos . En el ejemplo más simple de dicho ciclo, [17] un átomo de cloro reacciona con una molécula de ozono ( O
3), tomando un átomo de oxígeno para formar monóxido de cloro (ClO) y dejando una molécula de oxígeno ( O
2). El ClO puede reaccionar con una segunda molécula de ozono, liberando el átomo de cloro y produciendo dos moléculas de oxígeno. La abreviatura química para estas reacciones en fase gaseosa es:
El efecto general es una disminución de la cantidad de ozono, aunque la velocidad de estos procesos puede verse reducida por los efectos de los ciclos nulos . También se han descubierto mecanismos más complejos que conducen a la destrucción del ozono en la estratosfera inferior.
Un solo átomo de cloro destruiría continuamente el ozono (y por lo tanto un catalizador) durante hasta dos años (la escala de tiempo para el transporte de regreso a la troposfera), excepto por reacciones que lo eliminan de este ciclo formando especies reservorio como el cloruro de hidrógeno (HCl) y el nitrato de cloro ( ClONO).
2). El bromo es incluso más eficiente que el cloro en la destrucción del ozono por átomo, pero actualmente hay mucho menos bromo en la atmósfera. Tanto el cloro como el bromo contribuyen significativamente a la disminución general del ozono. Los estudios de laboratorio también han demostrado que los átomos de flúor y yodo participan en ciclos catalíticos análogos. Sin embargo, los átomos de flúor reaccionan rápidamente con el vapor de agua, el metano y el hidrógeno para formar fluoruro de hidrógeno (HF) fuertemente ligado en la estratosfera de la Tierra [18] , mientras que las moléculas orgánicas que contienen yodo reaccionan tan rápidamente en la atmósfera inferior que no alcanzan la estratosfera en cantidades significativas [19] .
Un solo átomo de cloro es capaz de reaccionar con un promedio de 100.000 moléculas de ozono antes de ser eliminado del ciclo catalítico. Este hecho, sumado a la cantidad de cloro que los clorofluorocarbonos (CFC) e hidroclorofluorocarbonos (HCFC) liberan a la atmósfera anualmente, demuestra el peligro que representan los CFC y los HCFC para el medio ambiente. [20] [21]

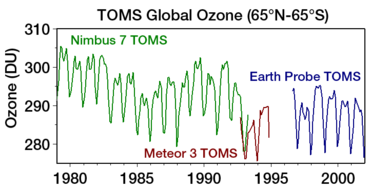
El agujero de ozono se mide generalmente por la reducción de la columna de ozono total sobre un punto de la superficie de la Tierra. Esto normalmente se expresa en unidades Dobson , abreviadas como "DU". La disminución más notable del ozono se ha producido en la estratosfera inferior. Se han observado descensos marcados en la columna de ozono en la primavera y principios del verano antártico en comparación con principios de la década de 1970 y antes utilizando instrumentos como el Espectrómetro de Cartografía del Ozono Total (TOMS). [22]
En la primavera austral (hemisferio sur) sobre la Antártida se observan reducciones de hasta el 70 por ciento en la columna de ozono, de las que se informó por primera vez en 1985 (Farman et al.). Desde la década de 1990, el ozono total de la columna antártica en septiembre y octubre ha seguido siendo entre un 40 y un 50 por ciento inferior a los valores anteriores al agujero de ozono. [1] En 2016 se informó de una tendencia gradual hacia la "curación" . [23] En 2017, la NASA anunció que el agujero de ozono era el más débil desde 1988 debido a las cálidas condiciones estratosféricas. Se espera que se recupere alrededor de 2070. [24]
La cantidad de agua que se pierde varía más de un año a otro en el Ártico que en la Antártida. Las mayores disminuciones en el Ártico se producen en invierno y primavera, y llegan hasta el 30 por ciento, cuando la estratosfera está más fría. [25]
Las reacciones que tienen lugar en las nubes estratosféricas polares (PSC) desempeñan un papel importante en el aumento de la pérdida de ozono. [26] Las PSC se forman más fácilmente en el frío extremo de la estratosfera ártica y antártica. Por eso los agujeros de ozono se formaron primero, y son más profundos, sobre la Antártida. Los primeros modelos no tuvieron en cuenta las PSC y predijeron un agotamiento global gradual, por lo que el repentino agujero de ozono antártico fue una sorpresa para muchos científicos. [27] [28] [29]
Es más preciso hablar de agotamiento del ozono en las latitudes medias que de agujeros. El ozono total en columna disminuyó por debajo de los valores anteriores a 1980 entre 1980 y 1996 en las latitudes medias. En las latitudes medias del norte, aumentó desde el valor mínimo en aproximadamente un dos por ciento entre 1996 y 2009, cuando entraron en vigor las regulaciones y disminuyó la cantidad de cloro en la estratosfera. En las latitudes medias del hemisferio sur, el ozono total se mantuvo constante durante ese período de tiempo. No hay tendencias significativas en los trópicos, en gran parte porque los compuestos que contienen halógenos no han tenido tiempo de descomponerse y liberar átomos de cloro y bromo en las latitudes tropicales. [1] [30]
Se ha demostrado que las grandes erupciones volcánicas tienen efectos de agotamiento de la capa de ozono sustanciales, aunque desiguales, como se observó en la erupción del monte Pinatubo en Filipinas en 1991. [31]
El agotamiento del ozono también explica gran parte de la reducción observada en las temperaturas de la estratosfera y la troposfera superior. [32] [33] La fuente del calor de la estratosfera es la absorción de la radiación ultravioleta por el ozono, por lo que la reducción del ozono conduce al enfriamiento. También se prevé cierto enfriamiento estratosférico a partir del aumento de los gases de efecto invernadero, como el CO
2y los propios CFC; sin embargo, el enfriamiento inducido por el ozono parece ser dominante. [34]
Las predicciones de los niveles de ozono siguen siendo difíciles, pero la precisión de las predicciones de los modelos de los valores observados y la concordancia entre las diferentes técnicas de modelado han aumentado de forma constante. [1] El Proyecto Mundial de Investigación y Vigilancia del Ozono de la Organización Meteorológica Mundial, Informe Nº 44, está firmemente a favor del Protocolo de Montreal , pero señala que una evaluación del PNUMA de 1994 sobreestimó la pérdida de ozono para el período 1994-1997. [35]
Los clorofluorocarbonos (CFC) y otras sustancias halogenadas que agotan la capa de ozono (SAO) son los principales responsables de la destrucción química del ozono provocada por el hombre. La cantidad total de halógenos efectivos (cloro y bromo) en la estratosfera se puede calcular y se conoce como cloro estratosférico efectivo equivalente (EESC). [36]
Los CFC como refrigerantes fueron inventados por Thomas Midgley Jr. en la década de 1930. [37] Se utilizaban en unidades de aire acondicionado y refrigeración, como propelentes de aerosoles antes de la década de 1970 y en los procesos de limpieza de equipos electrónicos delicados. También se producen como subproductos de algunos procesos químicos. Nunca se han identificado fuentes naturales significativas para estos compuestos: su presencia en la atmósfera se debe casi en su totalidad a la fabricación humana. Como se mencionó anteriormente, cuando estos productos químicos que agotan la capa de ozono llegan a la estratosfera, se disocian con luz ultravioleta para liberar átomos de cloro. Los átomos de cloro actúan como catalizadores y cada uno puede descomponer decenas de miles de moléculas de ozono antes de ser eliminados de la estratosfera. Dada la longevidad de las moléculas de CFC, los tiempos de recuperación se miden en décadas. Se calcula que una molécula de CFC tarda una media de cinco a siete años en ir desde el nivel del suelo hasta la atmósfera superior, y puede permanecer allí durante aproximadamente un siglo, destruyendo hasta cien mil moléculas de ozono durante ese tiempo. [38] [ verificación necesaria ]
El 1,1,1-tricloro-2,2,2-trifluoroetano , también conocido como CFC-113a, es una de las cuatro sustancias químicas artificiales que un equipo de la Universidad de East Anglia ha descubierto recientemente en la atmósfera. El CFC-113a es el único CFC conocido cuya abundancia en la atmósfera sigue aumentando. Su origen sigue siendo un misterio, pero algunos sospechan que se fabrica ilegalmente. El CFC-113a parece haberse acumulado sin cesar desde 1960. Entre 2012 y 2017, las concentraciones del gas aumentaron un 40 por ciento. [39]
Un estudio realizado por un equipo internacional de investigadores publicado en Nature concluyó que desde 2013 las emisiones provenientes principalmente del noreste de China han liberado grandes cantidades de clorofluorocarbono-11 (CFC-11) a la atmósfera. Los científicos estiman que, si no se toman medidas, estas emisiones de CFC-11 retrasarán una década la recuperación del agujero de ozono del planeta. [40] [41] [42]
Los satélites que se queman al reingresar a la atmósfera terrestre producen nanopartículas de óxido de aluminio ( Al2O3 ) que perduran en la atmósfera durante décadas. [43] Solo para 2022, se estima que habrá unas 17 toneladas métricas (unos 30 kg de nanopartículas por cada satélite de unos 250 kg). [43] El aumento de la población de constelaciones de satélites puede acabar provocando un agotamiento significativo del ozono. [43]
Los científicos han atribuido la disminución del ozono al aumento de compuestos halógenos de origen humano (antropogénicos) a partir de los CFC combinando datos de observación con modelos informáticos. Estos complejos modelos de transporte químico (por ejemplo, SLIMCAT , CLaMS —Chemical Lagrangian Model of the Stratosphere) funcionan combinando mediciones de sustancias químicas y campos meteorológicos con constantes de velocidad de reacción química. Identifican reacciones químicas clave y procesos de transporte que ponen los productos de fotólisis de los CFC en contacto con el ozono.

El agujero de ozono antártico es una zona de la estratosfera antártica en la que los niveles recientes de ozono han descendido hasta un 33 por ciento de sus valores anteriores a 1975. [45] El agujero de ozono se produce durante la primavera antártica, desde septiembre hasta principios de diciembre, cuando fuertes vientos del oeste comienzan a circular alrededor del continente y crean un contenedor atmosférico. Dentro de este vórtice polar , más del 50 por ciento del ozono estratosférico inferior se destruye durante la primavera antártica. [46]
Como se explicó anteriormente, la causa principal de la disminución del ozono es la presencia de gases que contienen cloro (principalmente CFC y halocarbonos relacionados). En presencia de luz ultravioleta, estos gases se disocian, liberando átomos de cloro, que luego catalizan la destrucción del ozono. La disminución del ozono catalizada por Cl puede tener lugar en la fase gaseosa, pero se potencia sustancialmente en presencia de nubes estratosféricas polares (PSC). [47]
Estas nubes estratosféricas polares se forman durante el invierno, cuando hace mucho frío. Los inviernos polares son oscuros y consisten en tres meses sin radiación solar (luz solar). La falta de luz solar contribuye a una disminución de la temperatura y el vórtice polar atrapa y enfría el aire. Las temperaturas rondan o están por debajo de los -80 °C. Estas bajas temperaturas forman partículas de nubes. Hay tres tipos de nubes PSC: nubes de trihidrato de ácido nítrico, nubes de hielo de agua que se enfrían lentamente y nubes de hielo de agua que se enfrían rápidamente (nácar) que proporcionan superficies para reacciones químicas cuyos productos, en primavera, conducirán a la destrucción del ozono. [48]
Los procesos fotoquímicos involucrados son complejos pero bien comprendidos. La observación clave es que, por lo general, la mayor parte del cloro en la estratosfera reside en compuestos "de reserva", principalmente nitrato de cloro ( ClONO
2) así como productos finales estables como el HCl. La formación de productos finales elimina esencialmente el Cl del proceso de agotamiento del ozono. Los compuestos de reservorio secuestran el Cl, que luego puede estar disponible mediante la absorción de luz en longitudes de onda más cortas que 400 nm. [49] Durante el invierno y la primavera antárticos, las reacciones en la superficie de las partículas de las nubes estratosféricas polares convierten estos compuestos "de reservorio" en radicales libres reactivos (Cl y ClO). La desnitrificación es el proceso por el cual las nubes eliminan el NO
2de la estratosfera convirtiéndolo en ácido nítrico en partículas de PSC, que luego se pierden por sedimentación. Esto evita que el ClO recién formado se convierta nuevamente en ClONO
2.
El papel de la luz solar en la reducción del ozono es la razón por la que la reducción del ozono en la Antártida es mayor durante la primavera. Durante el invierno, aunque las PSC son más abundantes, no hay luz sobre el polo para impulsar las reacciones químicas. Sin embargo, durante la primavera, la luz solar regresa y proporciona energía para impulsar las reacciones fotoquímicas y fundir las nubes estratosféricas polares, liberando una cantidad considerable de ClO, que impulsa el mecanismo del agujero. Las temperaturas que aumentan hacia el final de la primavera rompen el vórtice alrededor de mediados de diciembre. A medida que el calor aumenta, el ozono y el NO
2A medida que el aire rico en ozono fluye desde latitudes más bajas, las PSC se destruyen, el proceso de agotamiento del ozono se detiene y el agujero de ozono se cierra. [50]
La mayor parte del ozono que se destruye se encuentra en la estratosfera inferior, en contraste con la pérdida mucho menor de ozono a través de reacciones homogéneas en fase gaseosa, que ocurre principalmente en la estratosfera superior. [51]
Dado que la capa de ozono absorbe la luz ultravioleta UVB del sol, el agotamiento de la capa de ozono aumenta los niveles de UVB en la superficie (en igualdad de condiciones), lo que podría provocar daños, incluido un aumento del cáncer de piel . Esta fue la razón del Protocolo de Montreal. Aunque las disminuciones del ozono estratosférico están bien relacionadas con los CFC y los aumentos de la UVB en la superficie, no hay evidencia observacional directa que vincule el agotamiento del ozono con una mayor incidencia de cáncer de piel y daño ocular en los seres humanos. Esto se debe en parte a que los rayos UVA , que también se han implicado en algunas formas de cáncer de piel, no son absorbidos por el ozono, y a que es casi imposible controlar las estadísticas de los cambios en el estilo de vida a lo largo del tiempo. El agotamiento del ozono también puede influir en los patrones de viento. [52]
El ozono, aunque es un componente minoritario de la atmósfera terrestre, es responsable de la mayor parte de la absorción de la radiación UVB. La cantidad de radiación UVB que penetra a través de la capa de ozono disminuye exponencialmente con el espesor y la densidad de la capa. [53] Cuando los niveles de ozono estratosférico disminuyen, niveles más altos de UVB alcanzan la superficie de la Tierra. [1] [54] La formación de fenoles impulsada por los rayos UV en los anillos de los árboles ha datado el comienzo del agotamiento del ozono en las latitudes septentrionales a finales del siglo XVIII. [55]
En octubre de 2008, la Agencia Espacial Ecuatoriana publicó un informe llamado HIPERION. El estudio utilizó instrumentos terrestres en Ecuador y datos de los últimos 28 años de 12 satélites de varios países, y encontró que la radiación UV que llega a las latitudes ecuatoriales era mucho mayor de lo esperado, con un índice UV que llegaba a 24 en Quito ; la OMS considera 11 como un índice extremo y un gran riesgo para la salud. El informe concluyó que los niveles de agotamiento de ozono alrededor de las latitudes medias del planeta ya están poniendo en peligro a grandes poblaciones en estas áreas. [56] Más tarde, CONIDA, la Agencia Espacial Peruana, publicó su propio estudio, que arrojó casi los mismos hallazgos que el estudio ecuatoriano.
La principal preocupación pública en relación con el agujero de ozono han sido los efectos del aumento de la radiación ultravioleta superficial sobre la salud humana. Hasta ahora, el agotamiento del ozono en la mayoría de los lugares ha sido típicamente de un pequeño porcentaje y, como se señaló anteriormente, no hay evidencia directa disponible de daños a la salud en la mayoría de las latitudes. Si los altos niveles de agotamiento observados en el agujero de ozono fueran comunes en todo el mundo, los efectos podrían ser sustancialmente más dramáticos. Como el agujero de ozono sobre la Antártida en algunos casos ha crecido tanto que afecta a partes de Australia , Nueva Zelanda , Chile , Argentina y Sudáfrica , los ambientalistas han estado preocupados de que el aumento de la radiación ultravioleta superficial pueda ser significativo. [57] La radiación ultravioleta (RUV) excesiva tiene efectos reductores en las tasas de fotosíntesis y el crecimiento de las comunidades de diatomeas bentónicas (especies de microalgas que aumentan la calidad del agua y son resistentes a la contaminación) que están presentes en aguas dulces poco profundas. [58] El agotamiento del ozono no solo afecta la salud humana sino que también tiene un profundo impacto en la biodiversidad. Daña a las plantas y árboles a nivel celular, afectando su crecimiento, vitalidad, fotosíntesis, equilibrio hídrico y mecanismos de defensa contra plagas y enfermedades. Esto desencadena una cascada de impactos ecológicos, dañando a los microbios del suelo, los insectos, la vida silvestre y ecosistemas enteros. [59]
La disminución de la capa de ozono magnificaría todos los efectos de la radiación ultravioleta sobre la salud humana , tanto positivos (incluida la producción de vitamina D) como negativos (incluidas las quemaduras solares, el cáncer de piel y las cataratas). Además, el aumento de la radiación ultravioleta en la superficie provoca un aumento del ozono troposférico, lo que supone un riesgo para la salud humana. [60]
Las formas más comunes de cáncer de piel en humanos, los carcinomas de células basales y escamosas , se han relacionado estrechamente con la exposición a la radiación UV-B. El mecanismo por el cual la radiación UV-B induce estos cánceres es bien conocido: la absorción de la radiación UV-B hace que las bases de pirimidina en la molécula de ADN formen dímeros , lo que da lugar a errores de transcripción cuando el ADN se replica. Estos cánceres son relativamente leves y rara vez son mortales, aunque el tratamiento del carcinoma de células escamosas a veces requiere una cirugía reconstructiva extensa. Al combinar datos epidemiológicos con resultados de estudios en animales, los científicos han estimado que cada disminución del 1% en el ozono estratosférico a largo plazo aumentaría la incidencia de estos cánceres en un 2%. [61]
Otra forma de cáncer de piel, el melanoma maligno , es mucho menos común pero mucho más peligroso, siendo letal en alrededor del 15 al 20 por ciento de los casos diagnosticados. La relación entre el melanoma maligno y la exposición a la luz ultravioleta aún no se entiende completamente, pero parece que tanto la radiación UV-B como la UV-A están involucradas. Debido a esta incertidumbre, es difícil estimar el efecto del agotamiento del ozono en la incidencia del melanoma. Un estudio mostró que un aumento del 10 por ciento en la radiación UV-B se asoció con un aumento del 19 por ciento en los melanomas para los hombres y del 16 por ciento para las mujeres. [62] Un estudio de personas en Punta Arenas , en el extremo sur de Chile , mostró un aumento del 56 por ciento en el melanoma y un aumento del 46 por ciento en el cáncer de piel no melanoma durante un período de siete años, junto con una disminución de los niveles de ozono y un aumento de los niveles de UVB. [63]
Los estudios epidemiológicos sugieren una asociación entre las cataratas corticales oculares y la exposición a la radiación UV-B, utilizando aproximaciones rudimentarias de la exposición y diversas técnicas de evaluación de cataratas. Se realizó una evaluación detallada de la exposición ocular a la radiación UV-B en un estudio sobre los pescadores de la bahía de Chesapeake, donde los aumentos en la exposición ocular anual promedio se asociaron con un mayor riesgo de opacidad cortical. [64] En este grupo altamente expuesto de hombres predominantemente blancos, la evidencia que vincula las opacidades corticales con la exposición a la luz solar fue la más sólida hasta la fecha. Según estos resultados, se predice que el agotamiento del ozono causará cientos de miles de cataratas adicionales para el año 2050. [65]
El aumento de la radiación ultravioleta en la superficie provoca un aumento del ozono troposférico . El ozono troposférico se considera un riesgo para la salud, ya que es tóxico debido a sus fuertes propiedades oxidantes . Los riesgos son especialmente altos para los niños pequeños, los ancianos y las personas con asma u otras dificultades respiratorias. En la actualidad, el ozono a nivel del suelo se produce principalmente por la acción de la radiación ultravioleta sobre los gases de combustión de los escapes de los vehículos. [66]
La vitamina D se produce en la piel por la acción de la luz ultravioleta. Por lo tanto, una mayor exposición a la radiación UVB aumenta la vitamina D en las personas con deficiencia de esta vitamina. [67] Investigaciones recientes (principalmente desde el Protocolo de Montreal) muestran que muchos seres humanos tienen niveles de vitamina D inferiores a los óptimos. En particular, en la población estadounidense, se encontró que el nivel más bajo de vitamina D (<17,8 ng/ml) se asociaba, según los datos de la Encuesta Nacional de Examen de Salud y Nutrición, a un aumento de la mortalidad por todas las causas en la población general. [68] Aunque un nivel de vitamina D en sangre superior a 100 ng/ml parece aumentar excesivamente el calcio en sangre y estar asociado a una mayor mortalidad, el cuerpo tiene mecanismos que impiden que la luz solar produzca vitamina D en exceso de los requerimientos corporales. [69]
Un informe de noviembre de 2011 elaborado por científicos del Instituto de Zoología de Londres (Inglaterra) concluyó que las ballenas de la costa de California han experimentado un marcado aumento de los daños causados por el sol, y estos científicos "temen que la causa sea el adelgazamiento de la capa de ozono". [70] El estudio fotografió y tomó biopsias de piel de más de 150 ballenas del golfo de California y encontró "evidencia generalizada de daño epidérmico comúnmente asociado con quemaduras solares agudas y graves", ya que tienen células que se forman cuando el ADN se daña por la radiación ultravioleta. Los hallazgos sugieren que "el aumento de los niveles de rayos ultravioleta como resultado del agotamiento del ozono es el culpable del daño cutáneo observado, de la misma manera que las tasas de cáncer de piel en humanos han aumentado en las últimas décadas". [71] Además de las ballenas, muchos otros animales, como perros, gatos, ovejas y ecosistemas terrestres, también sufren los efectos negativos del aumento de las radiaciones UV-B. [72]
Sería de esperar que un aumento de la radiación ultravioleta afectara a los cultivos. Varias especies de plantas económicamente importantes, como el arroz , dependen de las cianobacterias que residen en sus raíces para la retención de nitrógeno . Las cianobacterias son sensibles a la radiación ultravioleta y se verían afectadas por su aumento. [73] "A pesar de los mecanismos para reducir o reparar los efectos del aumento de la radiación ultravioleta, las plantas tienen una capacidad limitada para adaptarse a niveles aumentados de UVB, por lo tanto, el crecimiento de las plantas puede verse afectado directamente por la radiación UVB". [74]
Con el paso de los años, la capa de ozono del Ártico se ha reducido gravemente. Como consecuencia, las especies que viven por encima de la capa de nieve o en zonas donde la nieve se ha derretido abundantemente, debido a las altas temperaturas, se ven afectadas negativamente debido a la radiación UV que llega al suelo. [75] Inicialmente, se supondría que el agotamiento de la capa de ozono y el exceso de radiación UVB aumentan el daño al ADN de las plantas. Los informes han encontrado que cuando las plantas se exponen a la radiación UVB similar al agotamiento del ozono estratosférico, no hubo un cambio significativo en la altura de la planta o la masa de las hojas, pero mostraron una respuesta en la biomasa de los brotes y el área foliar con una pequeña disminución. [76] Sin embargo, se ha demostrado que la radiación UVB disminuye el rendimiento cuántico del fotosistema II. [77] El daño UVB solo ocurre bajo exposición extrema, y la mayoría de las plantas también tienen flavonoides que absorben UVB que les permiten aclimatarse a la radiación presente. Las plantas experimentan diferentes niveles de radiación UV a lo largo del día. Se sabe que pueden cambiar los niveles y tipos de filtros solares UV (es decir, flavonoides) que contienen a lo largo del día. Esto les permite aumentar su protección contra la radiación UV. [78] Las plantas que se han visto afectadas por la radiación durante su desarrollo se ven más afectadas por la incapacidad de interceptar la luz con una mayor superficie foliar que por tener sistemas fotosintéticos comprometidos. [79] Es más probable que el daño de la radiación UVB sea significativo en las interacciones entre especies que en las propias plantas. [80]
Otro impacto significativo de la pérdida de ozono en la vida vegetal es el estrés que sufren las plantas cuando se exponen a la radiación ultravioleta. Esto puede provocar una disminución del crecimiento de las plantas y un aumento del estrés oxidativo, debido a la producción de óxido nítrico y peróxido de hidrógeno. [81] En las zonas donde se ha producido una pérdida sustancial de ozono, el aumento de la radiación UV-B reduce la productividad de las plantas terrestres (y también el secuestro de carbono) en aproximadamente un 6%. [82] [83]
Además, si las plantas se exponen a niveles elevados de radiación ultravioleta, pueden producir compuestos orgánicos volátiles nocivos , como los isoprenos. La emisión de isoprenos al aire por parte de las plantas puede afectar gravemente al medio ambiente, ya que aumenta la contaminación atmosférica y la cantidad de carbono en la atmósfera, lo que en última instancia contribuye al cambio climático. [84]
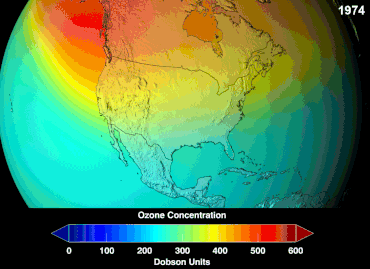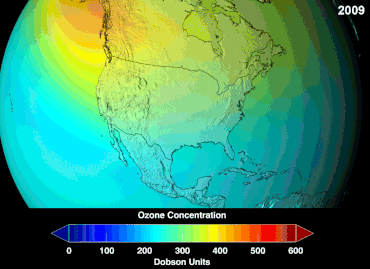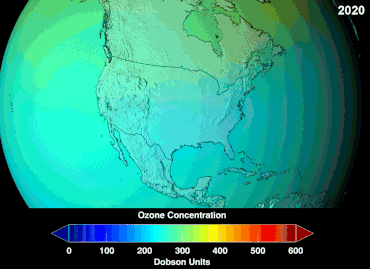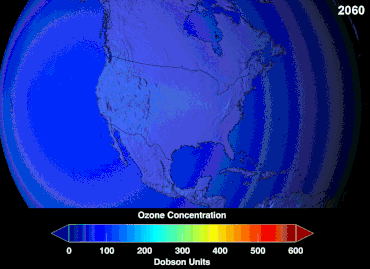
No se conoce la magnitud total de los daños que los CFC han causado a la capa de ozono y no se conocerá durante décadas; sin embargo, ya se han observado marcadas disminuciones en la columna de ozono. Las convenciones de Montreal y Viena se establecieron mucho antes de que se estableciera un consenso científico o se resolvieran importantes incertidumbres en el campo científico. [85] El caso del ozono era comprendido relativamente bien por los profanos, ya que, por ejemplo, el escudo de ozono o el agujero de ozono eran "metáforas de transición fáciles de entender" útiles. [86] Los estadounidenses dejaron de usar aerosoles voluntariamente, lo que resultó en una pérdida de ventas del 50 por ciento incluso antes de que se aplicara la legislación. [86]
Después de que un informe de 1976 de la Academia Nacional de Ciencias de los Estados Unidos concluyera que había pruebas científicas creíbles que apoyaban la hipótesis del agotamiento del ozono [87] , unos pocos países, entre ellos Estados Unidos, Canadá, Suecia, Dinamarca y Noruega, decidieron eliminar el uso de CFC en los aerosoles. [88] En aquel momento, esto se consideró ampliamente como un primer paso hacia una política de regulación más integral, pero el progreso en esta dirección se desaceleró en los años siguientes, debido a una combinación de factores políticos (la continua resistencia de la industria de los halocarbonos y un cambio general de actitud hacia la regulación ambiental durante los dos primeros años de la administración Reagan) y avances científicos (evaluaciones posteriores de la Academia Nacional que indicaron que las primeras estimaciones de la magnitud del agotamiento del ozono habían sido demasiado grandes).
En 1979, expiraba una patente crítica de DuPont para la fabricación de freón . En 1978, Estados Unidos prohibió el uso de CFC en aerosoles. [88] La Comunidad Europea rechazó las propuestas de prohibir los CFC en aerosoles y, en Estados Unidos, los CFC siguieron utilizándose como refrigerantes y para limpiar placas de circuitos. La producción mundial de CFC se redujo drásticamente después de la prohibición de los aerosoles en Estados Unidos, pero en 1986 había vuelto casi a su nivel de 1976. [88] En 1993, DuPont Canadá cerró su planta de CFC. [89]
La actitud del gobierno estadounidense comenzó a cambiar de nuevo en 1983, cuando William Ruckelshaus sustituyó a Anne M. Burford como administradora de la Agencia de Protección Ambiental de Estados Unidos (EPA). Bajo la dirección de Ruckelshaus y su sucesor, Lee Thomas, la EPA impulsó un enfoque internacional para las regulaciones de los halocarbonos. En 1985, veinte naciones, entre ellas la mayoría de los principales productores de CFC, firmaron la Convención de Viena para la Protección de la Capa de Ozono , que estableció un marco para negociar regulaciones internacionales sobre sustancias que agotan la capa de ozono. Ese mismo año, se anunció el descubrimiento del agujero de ozono en la Antártida, lo que provocó un resurgimiento de la atención pública sobre el tema.
En 1987, representantes de 43 naciones firmaron el Protocolo de Montreal . Mientras tanto, la industria de los halocarbonos cambió su posición y comenzó a apoyar un protocolo para limitar la producción de CFC. Sin embargo, este cambio fue desigual, ya que DuPont actuó con mayor rapidez que sus homólogos europeos. DuPont puede haber temido una acción judicial relacionada con el aumento del cáncer de piel, especialmente porque la EPA había publicado un estudio en 1986 que afirmaba que se esperaban 40 millones de casos adicionales y 800.000 muertes por cáncer en los EE. UU. en los próximos 88 años. [90] La UE también cambió su posición después de que Alemania renunciara a su defensa de la industria de los CFC y comenzara a apoyar medidas para su regulación. El gobierno y la industria en Francia y el Reino Unido intentaron defender sus industrias productoras de CFC incluso después de que se hubiera firmado el Protocolo de Montreal. [91]
En Montreal, los participantes acordaron congelar la producción de CFC a los niveles de 1986 y reducirla en un 50 por ciento para 1999. [88] Después de que una serie de expediciones científicas a la Antártida produjeron evidencia convincente de que el agujero de ozono era efectivamente causado por el cloro y el bromo de organohalógenos artificiales, el Protocolo de Montreal fue fortalecido en una reunión de 1990 en Londres. Los participantes acordaron eliminar gradualmente los CFC y los halones por completo (aparte de una cantidad muy pequeña marcada para ciertos usos "esenciales", como los inhaladores para el asma ) para el año 2000 en los países no signatarios del Artículo 5 y para el año 2010 en los signatarios del Artículo 5 (menos desarrollados). [92] En una reunión de 1992 en Copenhague, Dinamarca, la fecha de eliminación gradual se adelantó a 1996. [92] En la misma reunión, el bromuro de metilo (MeBr), un fumigante utilizado principalmente en la producción agrícola, se agregó a la lista de sustancias controladas. En el caso de todas las sustancias controladas en virtud del Protocolo, se retrasaron los calendarios de eliminación gradual para los países menos desarrollados («artículo 5(1)»), y la eliminación gradual en esos países se apoyó con transferencias de conocimientos técnicos, tecnología y dinero de Partes no incluidas en el artículo 5(1) del Protocolo. Además, se podían solicitar exenciones de los calendarios acordados en virtud del proceso de Exención para Usos Esenciales (EUE) para sustancias distintas del bromuro de metilo y en virtud del proceso de Exención para Usos Críticos (CUE) para el bromuro de metilo. [93] [94]
La sociedad civil, incluidas especialmente las organizaciones no gubernamentales (ONG), desempeñó papeles críticos en todas las etapas del desarrollo de políticas que condujeron a la Conferencia de Viena, el Protocolo de Montreal y en la evaluación del cumplimiento posterior. [95] [96] [97] [98] Las principales empresas afirmaron que no existían alternativas a los HFC. [99] Un refrigerante de hidrocarburo seguro para la capa de ozono se desarrolló en un instituto tecnológico de Hamburgo, Alemania, que consistía en una mezcla de los gases de hidrocarburos propano y butano , y en 1992 llegó a la atención de la ONG Greenpeace. Greenpeace lo llamó "Greenfreeze". [100] [101] La ONG luego trabajó con éxito primero con una empresa pequeña y en dificultades para comercializar un electrodoméstico comenzando en Europa, luego en Asia y más tarde en América Latina, recibiendo un premio del PNUMA en 1997. [102] [103] Para 1995, Alemania había declarado ilegales los refrigeradores con CFC. [103] Desde 2004, corporaciones como Coca-Cola, Carlsberg e IKEA formaron una coalición para promover las unidades Greenfreeze, que no dañan la capa de ozono. La producción se extendió a empresas como Electrolux, Bosch y LG, y las ventas alcanzaron unos 300 millones de refrigeradores en 2008. [102] [104] En América Latina, una empresa argentina comenzó la producción de Greenfreeze en 2003, mientras que el gigante Bosch en Brasil comenzó un año después. [105] [106] En 2013, se utilizaba en unos 700 millones de refrigeradores, lo que representaba aproximadamente el 40 por ciento del mercado. [99]
En los Estados Unidos, sin embargo, el cambio ha sido mucho más lento. Hasta cierto punto, los CFC fueron reemplazados por los hidroclorofluorocarbonos ( HCFC ), menos dañinos, aunque persisten las preocupaciones con respecto a los HCFC también. En algunas aplicaciones, los hidrofluorocarbonos ( HFC ) se estaban utilizando para reemplazar los CFC. Los HFC, que no contienen cloro ni bromo, no contribuyen al agotamiento de la capa de ozono, aunque son potentes gases de efecto invernadero. El más conocido de estos compuestos es probablemente el HFC-134a ( R-134a ), que en los Estados Unidos ha reemplazado en gran medida al CFC-12 ( R-12 ) en los acondicionadores de aire de los automóviles. En análisis de laboratorio (un uso "esencial" anterior), las sustancias que agotan la capa de ozono pueden reemplazarse por otros solventes. [107] Las compañías químicas como Du Pont, cuyos representantes menospreciaron a Greenfreeze como "esa tecnología alemana", maniobraron a la EPA para bloquear la tecnología en los EE. UU. hasta 2011. [108] [109] [110] [111] Ben & Jerry's de Unilever y General Electric, impulsada por Greenpeace, había expresado un interés formal en 2008 que figuró en la aprobación final de la EPA. [102] [112]
En 2009, la UE reformuló su Reglamento sobre el ozono. La ley prohíbe las sustancias que agotan la capa de ozono con el objetivo de protegerla. [113] La lista de SAO sujetas al reglamento es la misma que la del Protocolo de Montreal, con algunas adiciones. [114]
Más recientemente, los expertos en políticas han abogado por esfuerzos para vincular los esfuerzos de protección del ozono con los esfuerzos de protección del clima. [115] [116] Muchas SAO también son gases de efecto invernadero, algunos agentes de forzamiento radiativo miles de veces más poderosos que el dióxido de carbono en el corto y mediano plazo. Por lo tanto, las políticas de protección de la capa de ozono han tenido beneficios en la mitigación del cambio climático . La reducción del forzamiento radiativo debido a las SAO probablemente enmascaró el verdadero nivel de los efectos del cambio climático de otros gases de efecto invernadero, y fue responsable de la "desaceleración" del calentamiento global a partir de mediados de los años 90. [117] [ cita(s) adicional(es) necesaria(s) ] Las decisiones políticas en un ámbito afectan los costos y la eficacia de las mejoras ambientales en el otro.
La OMI ha modificado la regla 12 del Anexo VI del Convenio MARPOL relativa a las sustancias que agotan la capa de ozono. A partir del 1 de julio de 2010, todos los buques a los que se aplica el Anexo VI del Convenio MARPOL deberán disponer de una lista de los equipos que utilizan sustancias que agotan la capa de ozono. La lista deberá incluir el nombre de la sustancia que agota la capa de ozono, el tipo y la ubicación del equipo, la cantidad en kilogramos y la fecha. Todos los cambios desde esa fecha deberán registrarse en un libro de registro de sustancias que agotan la capa de ozono a bordo, en el que se anotarán todas las liberaciones intencionadas o no intencionadas a la atmósfera. Además, también deberán registrarse los nuevos suministros de sustancias que agotan la capa de ozono o los desembarques en las instalaciones costeras.

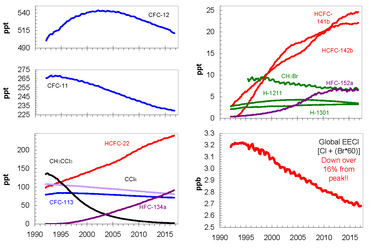
Desde que la adopción y el fortalecimiento del Protocolo de Montreal han permitido reducir las emisiones de CFC, las concentraciones atmosféricas de los compuestos más importantes han ido disminuyendo. Estas sustancias se están eliminando gradualmente de la atmósfera; desde que alcanzaron su nivel máximo en 1994, el nivel de cloro equivalente efectivo (EECl) en la atmósfera había disminuido alrededor de un 10 por ciento en 2008. La disminución de las sustancias químicas que agotan la capa de ozono también se ha visto afectada significativamente por una disminución de las sustancias químicas que contienen bromo . Los datos sugieren que existen importantes fuentes naturales de bromuro de metilo atmosférico ( CH
3Br ). [1] La eliminación progresiva de los CFC significa que el óxido nitroso ( N
2El O ), que no está cubierto por el Protocolo de Montreal, se ha convertido en la sustancia que más daña la capa de ozono se emite y se espera que siga siendo así durante todo el siglo XXI. [118]
Según el Sexto Informe de Evaluación del IPCC, los niveles mundiales de ozono estratosférico experimentaron una rápida disminución en los decenios de 1970 y 1980 y desde entonces han ido aumentando, pero no han alcanzado los niveles preindustriales. Aunque se prevé una variabilidad considerable de un año a otro, incluso en las regiones polares donde el agotamiento es mayor, se prevé que la capa de ozono siga recuperándose en las próximas décadas debido a la disminución de las concentraciones de sustancias que lo agotan, suponiendo que se cumpla plenamente el Protocolo de Montreal. [119]
Se espera que el agujero de ozono antártico continúe durante décadas. Las concentraciones de ozono en la estratosfera inferior sobre la Antártida aumentaron entre un 5 y un 10 por ciento para 2020 y volverán a los niveles anteriores a 1980 alrededor de 2060-2075. Esto es entre 10 y 25 años más tarde de lo previsto en evaluaciones anteriores, debido a las estimaciones revisadas de las concentraciones atmosféricas de sustancias que agotan la capa de ozono, incluido un mayor uso futuro previsto en los países en desarrollo. Otro factor que puede prolongar el agotamiento del ozono es la reducción de óxidos de nitrógeno de encima de la estratosfera debido al cambio en los patrones de viento. [120] En 2016 se informó de una tendencia gradual hacia la "curación" . [23] En 2019, el agujero de ozono fue el más pequeño de los treinta años anteriores, debido a que la estratosfera polar más cálida debilitó el vórtice polar. [121] En septiembre de 2023, el agujero de ozono antártico fue uno de los más grandes registrados, con 26 millones de kilómetros cuadrados. La pérdida anómalamente grande de ozono puede haber sido resultado de la erupción volcánica de Tonga de 2022. [ 122]
Los procesos físicos y químicos básicos que conducen a la formación de una capa de ozono en la estratosfera de la Tierra fueron descubiertos por Sydney Chapman en 1930. La radiación ultravioleta de longitud de onda corta divide el oxígeno ( O
2) en dos átomos de oxígeno (O), que luego se combinan con otras moléculas de oxígeno para formar ozono. El ozono se elimina cuando un átomo de oxígeno y una molécula de ozono "se recombinan" para formar dos moléculas de oxígeno, es decir, O + O
3→ 2 O
2En la década de 1950, David Bates y Marcel Nicolet presentaron pruebas de que diversos radicales libres, en particular el hidroxilo (OH) y el óxido nítrico (NO), podían catalizar esta reacción de recombinación, reduciendo la cantidad total de ozono. Se sabía que estos radicales libres estaban presentes en la estratosfera, por lo que se consideraban parte del equilibrio natural: se estimaba que, en su ausencia, la capa de ozono tendría aproximadamente el doble de espesor que en la actualidad.
En 1970 Paul Crutzen señaló que las emisiones de óxido nitroso ( N
2El óxido nitroso (NO ), un gas estable y de larga vida producido por las bacterias del suelo, de la superficie de la Tierra podría afectar la cantidad de óxido nítrico (NO) en la estratosfera. Crutzen demostró que el óxido nitroso vive lo suficiente para llegar a la estratosfera, donde se convierte en NO. Crutzen luego señaló que el aumento del uso de fertilizantes podría haber llevado a un aumento en las emisiones de óxido nitroso sobre el fondo natural, lo que a su vez daría como resultado un aumento en la cantidad de NO en la estratosfera. Por lo tanto, la actividad humana podría afectar la capa de ozono estratosférico. Al año siguiente, Crutzen y (independientemente) Harold Johnston sugirieron que las emisiones de NO de los aviones de pasajeros supersónicos , que volarían en la estratosfera inferior, también podrían agotar la capa de ozono. Sin embargo, un análisis más reciente realizado en 1995 por David W. Fahey, un científico atmosférico de la Administración Nacional Oceánica y Atmosférica , encontró que la caída del ozono sería de entre el 1 y el 2 por ciento si se operara una flota de 500 aviones de pasajeros supersónicos. [123] Esto, expresó Fahey, no sería un impedimento para el desarrollo avanzado de aviones de pasajeros supersónicos. [124]
En 1974, Frank Sherwood Rowland , profesor de química en la Universidad de California en Irvine, y su asociado postdoctoral Mario J. Molina sugirieron que los compuestos halógenos orgánicos de larga duración, como los CFC, podrían comportarse de manera similar a la que Crutzen había propuesto para el óxido nitroso. James Lovelock había descubierto recientemente, durante un crucero por el Atlántico Sur en 1971, que casi todos los compuestos CFC fabricados desde su invención en 1930 todavía estaban presentes en la atmósfera. Molina y Rowland concluyeron que, al igual que el N
2O , los CFC llegarían a la estratosfera, donde se disociarían por la luz ultravioleta, liberando átomos de cloro. Un año antes, Richard Stolarski y Ralph Cicerone, de la Universidad de Michigan, habían demostrado que el Cl es incluso más eficiente que el NO a la hora de catalizar la destrucción del ozono. Michael McElroy y Steven Wofsy, de la Universidad de Harvard , llegaron a conclusiones similares . Sin embargo, ninguno de los dos grupos se había dado cuenta de que los CFC fueran una fuente potencialmente grande de cloro estratosférico; en cambio, habían estado investigando los posibles efectos de las emisiones de HCl del transbordador espacial , que son mucho más pequeñas.
La hipótesis de Rowland-Molina fue fuertemente cuestionada por los representantes de las industrias de aerosoles y halocarbonos. El presidente de la junta directiva de DuPont fue citado diciendo que la teoría del agotamiento del ozono es "un cuento de ciencia ficción... un montón de basura... un completo disparate". [125] Robert Abplanalp , presidente de Precision Valve Corporation (e inventor de la primera válvula práctica para un aerosol), escribió al rector de la UC Irvine para quejarse de las declaraciones públicas de Rowland. [126] Sin embargo, en tres años la mayoría de las suposiciones básicas hechas por Rowland y Molina fueron confirmadas por mediciones de laboratorio y por observación directa en la estratosfera. Las concentraciones de los gases fuente (CFC y compuestos relacionados) y las especies de cloro reservorio (HCl y ClONO
2) se midieron en toda la estratosfera y demostraron que los CFC eran de hecho la principal fuente de cloro estratosférico y que casi todos los CFC emitidos eventualmente alcanzarían la estratosfera. Aún más convincente fue la medición, por James G. Anderson y colaboradores, del monóxido de cloro (ClO) en la estratosfera. El ClO se produce por la reacción de Cl con ozono; su observación demostró, por lo tanto, que los radicales Cl no solo estaban presentes en la estratosfera, sino que también estaban realmente involucrados en la destrucción del ozono. McElroy y Wofsy ampliaron el trabajo de Rowland y Molina al demostrar que los átomos de bromo eran catalizadores aún más efectivos para la pérdida de ozono que los átomos de cloro y argumentaron que los compuestos orgánicos bromados conocidos como halones , ampliamente utilizados en extintores de incendios, eran una fuente potencialmente grande de bromo estratosférico. En 1976, la Academia Nacional de Ciencias de los Estados Unidos publicó un informe que concluía que la hipótesis del agotamiento del ozono estaba fuertemente respaldada por la evidencia científica. En respuesta, Estados Unidos, Canadá y Noruega prohibieron el uso de CFC en aerosoles en 1978. Las primeras estimaciones indicaban que, si la producción de CFC continuaba a los niveles de 1977, el ozono atmosférico total alcanzaría, después de un siglo aproximadamente, un estado estable, entre un 15 y un 18 por ciento por debajo de los niveles normales. En 1984, cuando se disponía de mejores pruebas sobre la velocidad de las reacciones críticas, esta estimación se modificó a un agotamiento en estado estable de entre un 5 y un 9 por ciento. [127]
Crutzen, Molina y Rowland recibieron el Premio Nobel de Química en 1995 por su trabajo sobre el ozono estratosférico.
El descubrimiento del "agujero de ozono" antártico por los científicos del British Antarctic Survey Farman , Gardiner y Shanklin (publicado por primera vez en un artículo en Nature en mayo de 1985 [128] ) fue una sorpresa para la comunidad científica, porque la disminución observada en el ozono polar fue mucho mayor de lo que se había anticipado. [129] Las mediciones satelitales ( TOMS a bordo del Nimbus 7 ) que mostraban un agotamiento masivo del ozono alrededor del polo sur estaban disponibles al mismo tiempo. [130] Sin embargo, inicialmente fueron rechazadas por algoritmos de control de calidad de datos como irrazonables (se filtraron como errores ya que los valores eran inesperadamente bajos); el agujero de ozono se detectó solo en datos satelitales cuando los datos sin procesar se reprocesaron después de la evidencia de agotamiento del ozono en observaciones in situ . [91] Cuando se volvió a ejecutar el software sin las banderas, el agujero de ozono se vio ya en 1976. [131]
Susan Solomon , química atmosférica de la Administración Nacional Oceánica y Atmosférica (NOAA), propuso que las reacciones químicas en las nubes estratosféricas polares (PSC) en la fría estratosfera antártica causaron un aumento masivo, aunque localizado y estacional, en la cantidad de cloro presente en formas activas que destruyen el ozono. Las nubes estratosféricas polares en la Antártida solo se forman a temperaturas muy bajas, tan bajas como -80 °C, y en condiciones de principios de primavera. En tales condiciones, los cristales de hielo de la nube proporcionan una superficie adecuada para la conversión de compuestos de cloro no reactivos en compuestos de cloro reactivos, que pueden agotar fácilmente el ozono.
Además, el vórtice polar formado sobre la Antártida es muy estrecho y la reacción que ocurre en la superficie de los cristales de las nubes es muy diferente de la que ocurre en la atmósfera. Estas condiciones han llevado a la formación de un agujero de ozono en la Antártida. Esta hipótesis fue confirmada decisivamente, primero por mediciones de laboratorio y luego por mediciones directas, desde tierra y desde aviones de gran altitud , de concentraciones muy altas de monóxido de cloro (ClO) en la estratosfera antártica. [132]
También se pusieron a prueba hipótesis alternativas que atribuían el agujero de ozono a variaciones en la radiación ultravioleta solar o a cambios en los patrones de circulación atmosférica, y demostraron ser insostenibles. [133]
Mientras tanto, el análisis de las mediciones de ozono realizadas con la red mundial de espectrofotómetros Dobson terrestres llevó a un grupo internacional a concluir que, de hecho, la capa de ozono se estaba agotando en todas las latitudes fuera de los trópicos. [30] Estas tendencias fueron confirmadas por mediciones satelitales. Como consecuencia, las principales naciones productoras de halocarbonos acordaron eliminar gradualmente la producción de CFC, halones y compuestos relacionados, proceso que se completó en 1996.
Desde 1981, el Programa de las Naciones Unidas para el Medio Ambiente , bajo los auspicios de la Organización Meteorológica Mundial, ha patrocinado una serie de informes técnicos sobre la evaluación científica del agotamiento de la capa de ozono , basados en mediciones satelitales. El informe de 2007 mostró que el agujero en la capa de ozono se estaba recuperando y era el más pequeño que había sido en aproximadamente una década. [134]
Un informe de 2010 concluyó que "en el último decenio, el ozono global y el ozono en las regiones ártica y antártica ya no están disminuyendo, pero aún no están aumentando. Se prevé que la capa de ozono fuera de las regiones polares se recupere a sus niveles anteriores a 1980 algún tiempo antes de mediados de este siglo. En cambio, se espera que el agujero de ozono primaveral sobre la Antártida se recupere mucho más tarde". [135]
En 2012, la NOAA y la NASA informaron que "las temperaturas del aire más cálidas por encima de la Antártida provocaron el segundo agujero de ozono estacional más pequeño en 20 años, con un promedio de 17,9 millones de kilómetros cuadrados. El agujero alcanzó su tamaño máximo para la temporada el 22 de septiembre, extendiéndose hasta los 21,2 millones de kilómetros cuadrados". [136] Se informó de una tendencia gradual hacia la "curación" en 2016 [23] y luego en 2017. [137] Se informa de que la señal de recuperación es evidente incluso en las altitudes de saturación de pérdida de ozono. [138]
El agujero en la capa de ozono de la Tierra sobre el Polo Sur ha afectado la circulación atmosférica en el hemisferio sur hasta el ecuador. [139] El agujero de ozono ha influido en la circulación atmosférica hasta los trópicos y ha aumentado las precipitaciones en latitudes bajas y subtropicales en el hemisferio sur. [140]
El 3 de marzo de 2005, la revista Nature [141] publicó un artículo que vinculaba el inusualmente grande agujero de ozono del Ártico de 2004 con la actividad del viento solar.
El 15 de marzo de 2011 se observó una pérdida récord de la capa de ozono, ya que se había destruido aproximadamente la mitad del ozono presente sobre el Ártico. [142] [143] [144] El cambio se atribuyó a inviernos cada vez más fríos en la estratosfera del Ártico a una altitud de aproximadamente 20 km (12 mi), un cambio asociado con el calentamiento global en una relación que todavía está bajo investigación. [143] Para el 25 de marzo, la pérdida de ozono se había convertido en la más grande en comparación con la observada en todos los inviernos anteriores con la posibilidad de que se convirtiera en un agujero de ozono. [145] Esto requeriría que las cantidades de ozono cayeran por debajo de 200 unidades Dobson, de las 250 registradas sobre Siberia central. [145] Se predice que el adelgazamiento de la capa afectaría partes de Escandinavia y Europa del Este el 30 y 31 de marzo. [145]
El 2 de octubre de 2011, se publicó un estudio en la revista Nature , que decía que entre diciembre de 2010 y marzo de 2011 se destruyó hasta el 80 por ciento del ozono en la atmósfera a unos 20 kilómetros (12 millas) sobre la superficie. [146] El nivel de agotamiento del ozono fue lo suficientemente grave como para que los científicos dijeran que podía compararse con el agujero de ozono que se forma sobre la Antártida cada invierno. [146] Según el estudio, "por primera vez, se produjo una pérdida suficiente para ser descrita razonablemente como un agujero de ozono en el Ártico". [146] El estudio analizó datos de los satélites Aura y CALIPSO , y determinó que la pérdida de ozono mayor de lo normal se debió a un período inusualmente largo de clima frío en el Ártico, unos 30 días más de lo típico, lo que permitió que se crearan más compuestos de cloro que destruyen el ozono. [147] Según Lamont Poole, coautor del estudio, las partículas de nubes y aerosoles en las que se encuentran los compuestos de cloro "eran abundantes en el Ártico hasta mediados de marzo de 2011, mucho más tarde de lo habitual, con cantidades promedio en algunas altitudes similares a las observadas en la Antártida, y dramáticamente mayores que los valores cercanos a cero observados en marzo en la mayoría de los inviernos árticos". [147]
En 2013, los investigadores analizaron los datos y descubrieron que el evento del Ártico de 2010-2011 no alcanzó los niveles de agotamiento de ozono necesarios para clasificarlo como un verdadero agujero. Un agujero en la capa de ozono generalmente se clasifica como de 220 unidades Dobson o menos; [148] el agujero del Ártico no se acercó a ese nivel bajo. [149] [150] Desde entonces se lo ha clasificado como un "miniagujero". [151]
Tras el agotamiento de la capa de ozono en 1997 y 2011, en marzo de 2020 se midió una caída del 90% en la capa de ozono mediante globos meteorológicos sobre el Ártico, ya que normalmente registraban 3,5 partes por millón de ozono, en comparación con solo alrededor de 0,3 partes por millón por último, debido a las temperaturas más frías jamás registradas desde 1979, y un fuerte vórtice polar que permitió que los productos químicos, incluidos el cloro y el bromo, redujeran el ozono. [152]
En 2020 se estudió un raro agujero, resultado de temperaturas inusualmente bajas en la atmósfera sobre el Polo Norte. [153] [154]
Como los inviernos más fríos se ven más afectados, a veces se produce un agujero de ozono sobre el Tíbet. En 2006, se detectó un agujero de ozono de 2,5 millones de kilómetros cuadrados sobre el Tíbet. [155] De nuevo en 2011, apareció un agujero de ozono sobre las regiones montañosas del Tíbet , Xinjiang , Qinghai y el Hindu Kush , junto con un agujero sin precedentes sobre el Ártico, aunque el del Tíbet fue mucho menos intenso que los del Ártico o la Antártida. [156]
Una investigación realizada en 2012 mostró que el mismo proceso que produce el agujero de ozono sobre la Antártida ocurre sobre las nubes de tormenta de verano en los Estados Unidos y, por lo tanto, podría estar destruyendo el ozono allí también. [157] [158]
El físico Qing-Bin Lu, de la Universidad de Waterloo, afirmó haber descubierto un gran agujero de ozono durante todo el año en la estratosfera inferior sobre los trópicos en julio de 2022. [159] Sin embargo, otros investigadores en el campo refutaron esta afirmación, afirmando que la investigación estaba plagada de "errores graves y afirmaciones sin fundamento". [160] Según el Dr. Paul Young, autor principal de la Evaluación científica de 2022 de la OMM y el PNUMA sobre el agotamiento de la capa de ozono, "la identificación por parte del autor de un 'agujero de ozono tropical' se debe a que él observó los cambios porcentuales en el ozono, en lugar de los cambios absolutos, siendo estos últimos mucho más relevantes para los rayos UV dañinos que llegan a la superficie". En concreto, el trabajo de Lu define el "agujero de ozono" como "un área con una pérdida porcentual de O3 superior al 25%, con respecto al valor de O3 no perturbado cuando no había CFC significativos en la estratosfera (aproximadamente en la década de 1960)" [161] en lugar de la definición general de 220 unidades Dobson o inferior. La Dra. Marta Abalos Alvarez ha añadido que "el agotamiento del ozono en los trópicos no es nada nuevo y se debe principalmente a la aceleración de la circulación Brewer-Dobson".
Al analizar los impactos atmosféricos de la temporada de incendios forestales de Australia de 2019-2020 , los científicos dirigidos por la investigadora del MIT Susan Solomon descubrieron que el humo destruyó entre el 3 y el 5 % del ozono en las áreas afectadas del hemisferio sur. Las partículas de humo absorben el cloruro de hidrógeno y actúan como catalizador para crear radicales de cloro que destruyen el ozono. [162] [163] [164] [165]
Entre otros, Robert Watson tuvo un papel en la evaluación científica y en los esfuerzos de regulación del agotamiento del ozono y el calentamiento global . [85] Antes de la década de 1980, la UE, la NASA, la NAS, el PNUMA, la OMM y el gobierno británico tenían informes científicos disidentes y Watson jugó un papel en el proceso de evaluaciones unificadas. Basándose en la experiencia con el caso del ozono, el IPCC comenzó a trabajar en un informe unificado y una evaluación científica [85] para llegar a un consenso para proporcionar el Resumen del IPCC para los responsables de políticas .
Existen diversas áreas de vínculo entre el agotamiento del ozono y la ciencia del calentamiento global:

En 2019, la NASA informó que no había una relación significativa entre el tamaño del agujero de ozono y el cambio climático. [9]
Dado que las moléculas de CFC son más pesadas que el aire (nitrógeno u oxígeno), se cree comúnmente que las moléculas de CFC no pueden alcanzar la estratosfera en cantidades significativas. [169] Sin embargo, los gases atmosféricos no se clasifican por peso a estas altitudes; las fuerzas del viento pueden mezclar completamente los gases en la atmósfera. Algunos de los CFC más pesados no se distribuyen uniformemente. [170]

Otro error es que "se acepta generalmente que las fuentes naturales de cloro troposférico son cuatro o cinco veces mayores que las artificiales". Si bien esta afirmación es estrictamente cierta, el cloro troposférico es irrelevante; es el cloro estratosférico el que afecta al agotamiento del ozono. El cloro de la pulverización oceánica es soluble y, por lo tanto, es arrastrado por la lluvia antes de llegar a la estratosfera. Los CFC, en cambio, son insolubles y tienen una vida larga, lo que les permite llegar a la estratosfera. En la atmósfera inferior, hay mucho más cloro procedente de los CFC y haloalcanos relacionados que en el HCl procedente de la pulverización salina, y en la estratosfera predominan los halocarbonos. [171] Sólo el cloruro de metilo, que es uno de estos halocarbonos, tiene una fuente principalmente natural, [172] y es responsable de aproximadamente el 20 por ciento del cloro de la estratosfera; el 80 por ciento restante proviene de fuentes artificiales.
Las erupciones volcánicas muy violentas pueden inyectar HCl en la estratosfera, pero los investigadores [173] han demostrado que la contribución no es significativa en comparación con la de los CFC. Una afirmación errónea similar es que los compuestos halógenos solubles de la columna volcánica del Monte Erebus en la Isla Ross, Antártida, son un importante contribuyente al agujero de ozono antártico. [173]
Sin embargo, un estudio de 2015 [174] mostró que el papel del volcán Monte Erebus en el agotamiento del ozono antártico probablemente fue subestimado. Con base en los datos de reanálisis de NCEP/NCAR durante los últimos 35 años y utilizando el modelo de trayectoria NOAA HYSPLIT , los investigadores demostraron que las emisiones de gases del volcán Erebus (incluido el cloruro de hidrógeno (HCl)) pueden alcanzar la estratosfera antártica a través de ciclones de alta latitud y luego el vórtice polar . Dependiendo de la actividad del volcán Erebus, la masa anual adicional de HCl que ingresa a la estratosfera desde Erebus varía de 1,0 a 14,3 kt.
El GMB Dobson mencionó que cuando se midieron por primera vez los niveles de ozono primaveral en la Antártida sobre la bahía Halley en 1956, se sorprendió al descubrir que eran aproximadamente 320 DU, o aproximadamente 150 DU por debajo de los niveles primaverales del Ártico de aproximadamente 450 DU. En ese momento, estos eran los únicos valores conocidos de ozono antártico disponibles. Lo que Dobson describe es esencialmente la línea de base a partir de la cual se mide el agujero de ozono: los valores reales del agujero de ozono están en el rango de 150 a 100 DU. [175]
La discrepancia entre el Ártico y la Antártida observada por Dobson fue principalmente una cuestión de tiempo: durante la primavera ártica, los niveles de ozono aumentaron suavemente, alcanzando su punto máximo en abril, mientras que en la Antártida se mantuvieron aproximadamente constantes a principios de la primavera, aumentando abruptamente en noviembre, cuando se rompió el vórtice polar.
El comportamiento observado en el agujero de ozono antártico es diferente: en lugar de mantenerse constantes, los niveles de ozono a principios de primavera descienden hasta un 50 por ciento respecto de sus valores invernales, que ya eran bajos, y no vuelven a alcanzar los valores normales hasta diciembre. [176]
Algunas personas pensaban que el agujero de ozono debería estar por encima de las fuentes de CFC. Sin embargo, los CFC están bien mezclados a nivel mundial en la troposfera y la estratosfera . La razón de la aparición del agujero de ozono sobre la Antártida no es que haya más CFC concentrados, sino que las bajas temperaturas ayudan a formar nubes estratosféricas polares. [177] De hecho, se han encontrado "agujeros de ozono" importantes y localizados sobre otras partes de la Tierra, como por ejemplo sobre Asia Central. [178]
Son comunes los malentendidos y las ideas erróneas del público sobre cuestiones complejas como el agotamiento de la capa de ozono. El limitado conocimiento científico del público llevó a la confusión sobre el calentamiento global [179] o a la percepción del calentamiento global como un subconjunto del "agujero de ozono". [180] Al principio, las ONG verdes clásicas se abstuvieron de utilizar el agotamiento de los CFC para sus campañas, ya que asumieron que el tema era demasiado complicado. [85] Comenzaron a actuar mucho más tarde, por ejemplo, en el apoyo de Greenpeace a un refrigerador sin CFC producido por la antigua empresa de Alemania del Este VEB dkk Scharfenstein. [85] [181]
Las metáforas utilizadas en el debate sobre los CFC (escudo de ozono, agujero de ozono) no son "exactas" en el sentido científico. El "agujero de ozono" es más una depresión que un "agujero en el parabrisas". El ozono no desaparece a través de la capa, ni hay un "adelgazamiento" uniforme de la capa de ozono. Sin embargo, resonaron mejor entre los no científicos y sus preocupaciones. [86] El agujero de ozono fue visto como un "tema candente" y un riesgo inminente [182] ya que los legos temían graves consecuencias personales como cáncer de piel, cataratas, daño a las plantas y reducción de las poblaciones de plancton en la zona fótica del océano. No sólo a nivel de políticas, la regulación del ozono en comparación con el cambio climático tuvo mucho mejor desempeño en la opinión pública. Los estadounidenses dejaron voluntariamente de usar aerosoles antes de que se aplicara la legislación, mientras que el cambio climático no logró generar una preocupación y una acción pública comparables. [86] La repentina identificación en 1985 de que había un "agujero" sustancial fue ampliamente difundida en la prensa. La pérdida especialmente rápida de ozono en la Antártida había sido descartada anteriormente como un error de medición. [129] El consenso científico se estableció después de la regulación. [85]
Si bien el agujero de ozono antártico tiene un efecto relativamente pequeño sobre el ozono global, ha generado un gran interés público porque:
En 1994, la Asamblea General de las Naciones Unidas votó para designar el 16 de septiembre como el Día Internacional para la Preservación de la Capa de Ozono , o "Día Mundial del Ozono". [187] La designación conmemora la firma del Protocolo de Montreal [188] en esa fecha en 1987. [189]
Por lo tanto, la química del flúor no representa un sumidero significativo para el ozono estratosférico. Todo el flúor liberado de los gases fuente termina en forma de HF, que se acumula en la estratosfera (Fig. 8). ... La alta estabilidad del HF lo convierte en un trazador eficaz de la entrada de flúor en la estratosfera que surge de los gases antropogénicos fluorados
Iodine is a component of several gases that are naturally emitted from the oceans. Although iodine can participate in ozone destruction reactions, these iodine-containing source gases generally have very short lifetimes and, as a result, only a very small fraction reaches the stratosphere. There are large uncertainties in how these emissions vary with season and geographical region.
{{cite journal}}: CS1 maint: numeric names: authors list (link){{cite web}}: CS1 maint: unfit URL (link)Free radical reactions for ozone removal: Reaction 4.1
{{cite journal}}: CS1 maint: numeric names: authors list (link){{cite web}}: CS1 maint: unfit URL (link){{cite journal}}: CS1 maint: DOI inactive as of April 2024 (link){{cite book}}: CS1 maint: location missing publisher (link){{cite web}}: CS1 maint: unfit URL (link){{cite press release}}: CS1 maint: unfit URL (link){{cite web}}: CS1 maint: unfit URL (link){{cite web}}: CS1 maint: unfit URL (link){{cite web}}: CS1 maint: numeric names: authors list (link){{cite web}}: CS1 maint: unfit URL (link)