La química de organooro es el estudio de compuestos que contienen enlaces oro - carbono . Se estudian en la investigación académica, pero no han recibido un uso generalizado en otros ámbitos. Los estados de oxidación dominantes para los compuestos de organooro son I con número de coordinación 2 y una geometría molecular lineal y III con CN = 4 y una geometría molecular plana cuadrada . [1] [2] [3]
Los complejos de oro(I) son especies lineales, diamagnéticas , de 2 coordenadas y 14 electrones. [1] [2] [3] Normalmente existen como aductos LAuR con un ligando L, por ejemplo, una trifenilfosfina o un isocianuro. El ligando evita la reducción de Au(I) a Au(0) metálico con dimerización del residuo orgánico. El oro(I) también puede existir como aurato M[AuR 2 ] (el complejo ato ) por lo que el catión suele estar equipado con un agente complejante para mejorar la estabilidad. El anión AuR 2 − también es lineal al igual que otras especies M(d 10 ) como Hg(Me) 2 y Pd(Me) 2 2+ . Se sabe que el oro forma acetiluros (capaces de formar estructuras poliméricas), carbenos y carbinos [ cita requerida ] . El método clásico para la preparación de compuestos LAuR es mediante la reacción de un reactivo de Grignard con un haluro de oro (I) . Una reacción posterior con un organolitio R-Li forma el complejo ato.
En un grupo especial de compuestos, un átomo de carbono arílico actúa como un puente entre dos átomos de oro. Uno de estos compuestos, (MesAu) 5 , se forma en una reacción entre Au(CO)Cl y el mesitilo Grignard. El carbono puede coordinarse con el oro hasta un valor de 6. Los compuestos del tipo C(AuL) 4 son isolobales con el metano y los del tipo C(AuL) 5 + isolobales con el ion metanio. Estos grupos de organooro hipercoordinados a menudo se estabilizan mediante interacciones aurófilas entre los centros de oro formalmente de capa cerrada. [4]
Los compuestos de cianuro de oro ( MAu(CN) 2 ) son de cierta importancia para la cianuración de oro , un proceso para la extracción de oro de minerales de baja calidad. El enlace carbono-metal en los cianuros metálicos suele ser iónico, pero existe evidencia de que el enlace C-Au en el ion cianuro de oro es covalente. [5]
Los complejos de oro (III) son especies diamagnéticas , tóxicas, de 16 electrones , de cuatro coordenadas, planares cuadradas . Cuando el número de coordinación formal es menor que 4, los ligandos como el cloro pueden compensarlo formando un ligando puente. La quelación intramolecular es otra estrategia. En general, los compuestos de oro (III) son tóxicos y, por lo tanto, menos estudiados que los de oro (I). Los complejos de monoariloro (III) son una clase de complejos bien estudiada. A menudo se preparan mediante auración electrofílica directa de arenos con AuCl 3 . [6] Los complejos de tetraalquilaurato (III) homolépticos (por ejemplo, Li[AuMe 4 ]) también están bien caracterizados. [7]
Las reacciones catalizadas por oro se dividen en dos categorías principales: catálisis heterogénea, que incluye catalizadores mediante nanopartículas de oro (p. ej., Au/TiO 2 ) y superficies de oro de monocapa de tiol, y catalizadores sobre soporte de alúmina, incluido Au/CeO 2 soportado en alúmina . Estos catalizadores se han investigado para procesos industrialmente importantes como la oxidación de alcoholes, la oxidación de monóxido de carbono (CO) y varias reacciones de hidrogenación selectiva (p. ej., butadieno a buteno). Aunque a menudo son eficientes y exhiben selectividades útiles o únicas, existe una considerable incertidumbre con respecto al mecanismo de los procesos catalizados por varios catalizadores de oro heterogéneos, incluso en comparación con otros catalizadores de metales de transición heterogéneos.
Por el contrario, la catálisis homogénea con oro utiliza compuestos de oro(I) u oro(III) simples o unidos a ligando que son solubles en disolventes orgánicos y se utiliza para la síntesis de productos químicos finos en química orgánica. [8] [9] Los haluros de oro binarios y los complejos simples, incluidos el cloruro de oro(I) , el cloruro de oro(III) y el ácido cloroáurico , se han empleado como complejos. Sin embargo, estas fuentes de oro dan lugar rápidamente a catalizadores activos mal definidos y fácilmente desactivables (a través de la reducción a Au0 ) en solución. El desarrollo de complejos de oro(I) ligados a fosfina o NHC bien definidos fue un avance importante y condujo a un aumento significativo del interés en las aplicaciones sintéticas de la catálisis de oro. Los complejos de oro(I) ligados se preparan y almacenan típicamente como cloruros estables en banco (pero no reactivos), LAuCl, por ejemplo, cloro(trifenilfosfina)oro(I) , que típicamente se activan a través de la abstracción de haluros con sales de plata como AgOTf, AgBF4 o AgSbF6 para generar una especie de oro(I) catiónica. [10] [11] Aunque el complejo coordinativamente insaturado "LAu + " se genera nocionalmente a partir de una mezcla de LAuCl/AgX, la naturaleza exacta de la especie de oro catiónica y el papel de la sal de plata sigue siendo algo controvertido. [12] [13] [14] Los complejos de para -nitrobenzoato, bistriflimida y ciertos nitrilos representan precatalizadores libres de plata catalíticamente activos pero aislables.
El oro(I) catiónico forma complejos π con enlaces de alquenos o alquinos , siguiendo el modelo de Dewar–Chatt–Duncanson . El oro no es ciertamente el único metal que muestra este tipo de enlace y reactividad, varios iones metálicos isolobales con el protón simple (es decir, un orbital s vacío) también lo hacen: por ejemplo, el mercurio(II) y el platino(II). Los iones y complejos electrófilos como estos con una fuerte propensión a formar complejos π se conocen generalmente como pi(π)-ácidos (ver también: interacción catión–pi ). [15]
Los complejos de oro(I)-alqueno y -alquino son electrofílicos y susceptibles al ataque nucleofílico. En la oximercuración, la especie organomercurial resultante se genera estequiométricamente y requiere un paso adicional para liberar el producto. En el caso del oro, la protonólisis del enlace Au-C cierra el ciclo catalítico, lo que permite la coordinación de otro sustrato. Algunas ventajas prácticas de la catálisis de oro(I) incluyen: 1) estabilidad al aire (debido al alto potencial de oxidación de Au(I)), 2) tolerancia a la humedad adventicia (debido a su baja oxofilicidad) y 3) toxicidad relativamente baja en comparación con otros pi-ácidos (por ejemplo, Pt(II) y Hg(II)). Químicamente, los complejos de Au(I) normalmente no sufren oxidación a estados de oxidación más altos, y los Au(I)-alquilos y -vinilos no son susceptibles a la eliminación de hidruro β. [16]
En 1976, Thomas y sus colaboradores informaron sobre la conversión de fenilacetileno en acetofenona utilizando ácido tetracloroáurico con un rendimiento del 37 %. [17] En esta reacción se utilizó oro (III) como catalizador homogéneo en sustitución del mercurio en la oximercuración. Este mismo estudio enumera un rendimiento publicado >150 %, lo que indica una catálisis que tal vez no fue reconocida por los químicos.
En 1991, Utimoto hizo reaccionar oro(III) (NaAuCl 4 ) con alquinos y agua. [18] Teles identificó un inconveniente importante de este método, ya que el Au(III) se reducía rápidamente a oro metálico catalíticamente muerto y en 1998 volvió al tema del Au(I) soportado por ligando para la misma transformación: [19]
Esta reacción en particular demostró una eficiencia catalítica fantástica y desencadenaría una oleada de investigaciones sobre el uso de complejos de fosfina-oro(I) para la activación de enlaces múltiples CC en los años venideros. [20] A pesar de la menor estabilidad de los complejos de oro(III) en condiciones catalíticas, también se descubrió que el AuCl3 simple era un catalizador eficiente en algunos casos. Por ejemplo, Hashmi informó sobre una reacción de Diels-Alder de alquino/ furano catalizada por AuCl3 -un tipo de cicloadición que no ocurre ordinariamente- para la síntesis de fenoles 2,3-disustituidos : [21]
Estudios mecanicistas posteriores concluyen que no se trata de una transformación concertada, sino más bien de una hidroarilación inicial de alquino seguida de una serie de reordenamientos intramoleculares no obvios, que concluyen con una electrociclización 6π y una rearomatización.
Los efectos relativistas son significativos en la química del organooro debido a la gran carga nuclear del metal ( Z = 79). Como consecuencia de los orbitales 5 d expandidos relativistamente , el fragmento LAu puede estabilizar un carbocatión vecino a través de la donación de electrones en el orbital vacío de tipo p . Por lo tanto, además de su reactividad esperada similar a la del carbocatión, estos cationes también exhiben un carácter carbeno significativo, una propiedad que se ha explotado en transformaciones catalíticas como la ciclopropanación y la inserción de CH. [22] Los ésteres de propargilo pueden servir como precursores para los intermediarios catiónicos de oro-vinilcarbeno, que pueden reaccionar con alquenos de manera concertada para producir el producto de ciclopropanación. El uso de un ligando quiral ( ( R )-DTBM-SEGPHOS ) resultó en niveles buenos a excelentes de enantioselectividad. [23]


Aunque Echavarren fue el primero en informar sobre la preparación de complejos quirales de bisfosfinadigoro(I) para la catálisis enantioselectiva de oro que se lleva a cabo a través del mecanismo típico de activación pi, [24] un ejemplo temprano y atípico de catálisis enantioselectiva por oro fue descrito por Hayashi e Ito en 1986. [25] En este proceso, el benzaldehído y el isocianoacetato de metilo experimentan una ciclización en presencia de un ligando de ferrocenilfosfina quiral y un complejo de bis(isocianuro)oro(I) para formar una oxazolina quiral . Dado que las oxazolinas se pueden hidrolizar para proporcionar un 1,2-aminoalcohol, esta reacción constituye el primer ejemplo de una reacción aldólica catalítica asimétrica .
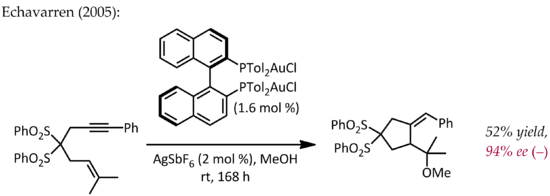
A diferencia de las otras reacciones descritas anteriormente, esta reacción no implica la activación de un doble o triple enlace CC por el oro. En una imagen mecanicista simple, el oro (I) se coordina simultáneamente con dos ligandos de fosfina y el grupo isocianato de carbono [26] que luego es atacado por el grupo carbonilo. Estudios posteriores sobre el modo de enlace del Au (I) indican que esta imagen simple puede tener que ser revisada.
La catálisis heterogénea del oro es una ciencia más antigua. El oro es un metal atractivo para su uso debido a su estabilidad frente a la oxidación y su variedad en morfología, por ejemplo, los materiales de cúmulos de oro . Se ha demostrado que el oro es eficaz en la oxidación de CO a baja temperatura y la cloración de acetileno a cloruros de vinilo. La naturaleza exacta del sitio catalítico en este tipo de proceso es objeto de debate. [27] La noción de que el oro puede catalizar una reacción no implica que sea la única forma. Sin embargo, otros metales pueden hacer el mismo trabajo de forma económica, en particular en los últimos años el hierro (véase química de organohierro ).
El oro cataliza muchas transformaciones orgánicas, generalmente la formación de enlaces carbono-carbono a partir de Au(I) y la formación de enlaces CX (X = O, N) a partir del estado Au(III), debido a la acidez de Lewis más dura de ese ion. Durante la última década, varios estudios han demostrado que el oro puede catalizar de manera eficiente las reacciones de acoplamiento cruzado de heteroátomos C y CC que se producen a través de un ciclo Au(I)/Au(III). [28] Hong C. Shen resumió las reacciones homogéneas que forman compuestos cíclicos en 4 categorías principales: [29]
Otras reacciones son el uso de oro en la activación de enlaces C–H [33] y las reacciones aldólicas. El oro también cataliza reacciones de acoplamiento . [34]
Si bien la hidrofuncionalización catalizada por oro de alquinos, alenos y alcoholes alílicos [35] ocurre fácilmente en condiciones comparativamente suaves, los alquenos no activados siguen siendo sustratos pobres en la mayoría de los casos [36] , en gran parte debido a la resistencia de los complejos intermedios de alquil-oro(I) a la protodesauración. [37] El desarrollo de transformaciones intermoleculares catalizadas por oro también ha quedado rezagado respecto del desarrollo de las intramoleculares. [38]