
El punto de restricción ( R ), también conocido como punto de control de inicio o G 1 /S , es un punto de control del ciclo celular en la fase G 1 del ciclo celular animal en el que la célula se "compromete" con el ciclo celular, y después del cual ya no se requieren señales extracelulares para estimular la proliferación. [1] La característica bioquímica definitoria del punto de restricción es la activación de los complejos ciclina-CDK de fase G 1 /S y S , que a su vez fosforilan proteínas que inician la replicación del ADN , la duplicación del centrosoma y otros eventos tempranos del ciclo celular. [2] Es uno de los tres puntos de control principales del ciclo celular, los otros dos son el punto de control de daño del ADN G2-M y el punto de control del huso .
Originalmente, Howard Martin Temin demostró que las células de pollo alcanzan un punto en el que se comprometen a replicar su ADN y no dependen de señales extracelulares. [3] Unos 20 años después, en 1973, Arthur Pardee demostró que existe un único punto de restricción en G 1 . Anteriormente, G 1 se había definido simplemente como el tiempo entre la mitosis y la fase S . No se conocían marcadores de lugar moleculares o morfológicos para la posición de una célula en G 1 . Pardee utilizó un método de doble bloque en el que cambió las células de un bloque del ciclo celular (como la retirada de aminoácidos críticos o la retirada de suero) a otro y comparó la eficiencia de cada bloque para prevenir la progresión a la fase S. Encontró que ambos bloques en todos los casos examinados eran igualmente eficientes para bloquear la progresión a la fase S, lo que indica que todos deben actuar en el mismo punto en G 1 , que denominó el "punto de restricción", o punto R. [4]
En 1985, Zetterberg y Larsson descubrieron que, en todas las etapas del ciclo celular, la privación de suero produce una inhibición de la síntesis de proteínas. Sólo en las células postmitóticas (es decir, las células en la fase G 1 temprana ) la privación de suero obligaba a las células a entrar en estado de quiescencia ( G 0 ). De hecho, Zetterberg descubrió que prácticamente toda la variabilidad en la duración del ciclo celular se puede explicar en el tiempo que tarda la célula en pasar del punto de restricción a la fase S. [5]
A excepción del desarrollo embrionario temprano, la mayoría de las células de los organismos multicelulares persisten en un estado de reposo conocido como G 0 , en el que no se produce proliferación y las células suelen estar diferenciadas terminalmente; otras células especializadas continúan dividiéndose hasta la edad adulta. Para ambos grupos de células, se ha tomado la decisión de salir del ciclo celular y volverse inactivos (G 0 ), o volver a entrar en G 1 .
La decisión de una célula de entrar o volver a entrar en el ciclo celular se toma antes de la fase S en G 1 en lo que se conoce como el punto de restricción, y está determinada por la combinación de señales extracelulares promotoras e inhibidoras que se reciben y procesan. Antes del punto R, una célula necesita estos estimulantes extracelulares para comenzar a progresar a través de las primeras tres subfases de G 1 (competencia, entrada G 1a , progresión G 1b ). Sin embargo, después de que se ha pasado el punto R en G 1b , las señales extracelulares ya no son necesarias, y la célula está irreversiblemente comprometida a prepararse para la duplicación del ADN . La progresión posterior está regulada por mecanismos intracelulares. La eliminación de estimulantes antes de que la célula alcance el punto R puede dar como resultado la reversión de la célula a la quiescencia. [1] [3] En estas condiciones, las células en realidad retroceden al ciclo celular y requerirán tiempo adicional (aproximadamente 8 horas más que el tiempo de retirada en cultivo) después de pasar el punto de restricción para entrar en la fase S. [3]
Señalización mitogénica
Los factores de crecimiento (p. ej., PDGF , FGF y EGF ) regulan la entrada de las células al ciclo celular y la progresión hasta el punto de restricción. Después de pasar este "punto de no retorno" similar a un interruptor, la finalización del ciclo celular ya no depende de la presencia de mitógenos. [6] [4] [7] La señalización sostenida de mitógenos promueve la entrada al ciclo celular en gran medida a través de la regulación de las ciclinas G1 (ciclina D1-3) y su ensamblaje con Cdk4/6, que puede mediarse en paralelo a través de las vías MAPK y PI3K.
Cascada de señalización MAPK
La unión de factores de crecimiento extracelulares a sus receptores de tirosina quinasas (RTK) desencadena un cambio conformacional y promueve la dimerización y autofosforilación de residuos de tirosina en la cola citoplasmática de las RTK. Estos residuos de tirosina fosforilados facilitan el acoplamiento de proteínas que contienen un dominio SH2 (p. ej., Grb2 ), que posteriormente puede reclutar otras proteínas de señalización a la membrana plasmática y desencadenar cascadas de quinasas de señalización. Grb2 asociado a RTK se une a Sos , que es un factor de intercambio de nucleótidos de guanina que convierte Ras unido a la membrana en su forma activa (Ras-GDP Ras-GTP). [8] Ras activo activa la cascada de quinasas MAP, uniéndose y activando Raf, que fosforila y activa MEK, que fosforila y activa ERK (también conocida como MAPK, consulte también la vía MAPK/ERK ).
La ERK activa luego se transloca al núcleo donde activa múltiples objetivos, como el factor de transcripción factor de respuesta al suero (SRF), lo que resulta en la expresión de genes tempranos inmediatos, en particular los factores de transcripción Fos y Myc . [8] [9] Los dímeros Fos/Jun comprenden el complejo de factores de transcripción AP-1 y activan genes de respuesta retardada, incluida la ciclina G1 principal , la ciclina D1 . [8] Myc también regula la expresión de una amplia variedad de genes pro-proliferativos y pro-crecimiento, incluida cierta inducción de ciclina D2 y Cdk4 . [5] Además, la actividad sostenida de ERK parece ser importante para la fosforilación y la localización nuclear de CDK2 , [8] lo que respalda aún más la progresión a través del punto de restricción.
Señalización de la vía PI3K
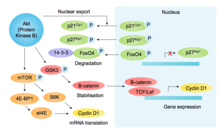
p85, otra proteína que contiene el dominio SH2, se une a las RTK activadas y recluta a PI3K (fosfoinosítido-3-quinasa), fosforilando el fosfolípido PIP2 a PIP3, lo que lleva al reclutamiento de Akt (a través de su dominio PH). Además de otras funciones pro-crecimiento y pro-supervivencia, Akt inhibe la glucógeno sintasa quinasa-3β ( GSK3β ), previniendo así la fosforilación mediada por GSK3β y la posterior degradación de la ciclina D1 [10] ( ver figura [11] ). Akt regula además los componentes G1/S mediante la promoción mediada por mTOR de la traducción de la ciclina D1, [12] la fosforilación de los inhibidores de Cdk p27 kip1 (previniendo su importación nuclear) y p21 Cip1 (disminuyendo la estabilidad), e inactivando la fosforilación del factor de transcripción FOXO4 (que regula la expresión de p27). [13] En conjunto, esta estabilización de la ciclina D1 y la desestabilización de los inhibidores de Cdk favorecen la actividad de G1 y G1/S-Cdk.
Señalización antimitógena
Los antimitógenos como la citocina TGF-β inhiben la progresión a través del punto de restricción, lo que provoca un arresto en G1. La señalización de TGF-β activa Smads, que se combina con E2F4 /5 para reprimir la expresión de Myc y también se asocia con Miz1 para activar la expresión del inhibidor de CDK p15 INK4b para bloquear la formación y la actividad del complejo ciclina D-Cdk. [8] [14] Las células detenidas con TGF-β también acumulan p21 y p27. [14]
Descripción general
Como se ha descrito anteriormente, las señales de los factores de crecimiento extracelulares se transducen de una manera típica. El factor de crecimiento se une a los receptores en la superficie celular y una variedad de cascadas de fosforilación dan como resultado la captación de Ca2 + y la fosforilación de proteínas. Los niveles de fosfoproteínas son contrarrestados por las fosfatasas. En última instancia, se produce la activación transcripcional de ciertos genes diana. La señalización extracelular debe mantenerse y la célula también debe tener acceso a suficientes suministros de nutrientes para apoyar la síntesis rápida de proteínas. La acumulación de ciclina D es esencial. [15]
Las Cdk 4 y 6 unidas a la ciclina D son activadas por la quinasa activadora de Cdk y conducen a la célula hacia el punto de restricción. Sin embargo, la ciclina D tiene una alta tasa de recambio (t 1/2 <25 min). Es debido a esta rápida tasa de recambio que la célula es extremadamente sensible a los niveles de señalización mitogénica, que no solo estimulan la producción de ciclina D, sino que también ayudan a estabilizar la ciclina D dentro de la célula. [15] [16] De esta manera, la ciclina D actúa como un sensor de señal mitogénica. [16] Los inhibidores de Cdk (CKI), como las proteínas Ink4 y p21 , ayudan a prevenir la actividad inadecuada de ciclina-cdk.
Los complejos de ciclina D-cdk activos fosforilan la proteína del retinoblastoma (pRb) en el núcleo. La Rb no fosforilada actúa como un inhibidor de G 1 al impedir la transcripción mediada por E2F . Una vez fosforilada, la E2F activa la transcripción de las ciclinas E y A. [15] [16] [17] La ciclina E-cdk activa comienza a acumularse y completa la fosforilación de pRb, como se muestra en la figura. [18]
Inhibidores de CDK y regulación de la actividad del complejo Ciclina D/Cdk
p27 y p21 son inhibidores estequiométricos de los complejos G1/S- y S-ciclina-Cdk. Mientras que los niveles de p21 aumentan durante la entrada al ciclo celular, p27 generalmente se inactiva a medida que las células progresan hasta la etapa final del ciclo celular. [8] La alta densidad celular, la falta de mitógenos y el TGF-β dan como resultado la acumulación de p27 y la detención del ciclo celular. [14] De manera similar, el daño del ADN y otros factores estresantes aumentan los niveles de p21, mientras que la actividad de ERK2 y Akt estimulada por mitógenos conduce a la inactivación de la fosforilación de p21. [19]
Los primeros trabajos sobre la sobreexpresión de p27 sugirieron que puede asociarse con e inhibir los complejos ciclina D-Cdk4/6 y los complejos ciclina E/A-Cdk2 in vitro y en tipos de células selectos. [14] Sin embargo, los estudios cinéticos de LaBaer et al. (1997) encontraron que la titulación en p21 y p27 promueve el ensamblaje del complejo ciclina d-Cdk, aumentando la actividad general y la localización nuclear del complejo. [20] Estudios posteriores dilucidaron que p27 puede ser necesario para la formación del complejo ciclina D-Cdk, ya que los MEF p27 -/- , p21 -/- mostraron una disminución en la complexación ciclina D-Cdk4 que podría ser rescatada con la reexpresión de p27. [21]
El trabajo de James et al. (2008) sugiere además que la fosforilación de residuos de tirosina en p27 puede cambiar p27 entre un estado inhibidor y no inhibidor mientras está unido a ciclina D-Cdk4/6, ofreciendo un modelo de cómo p27 es capaz de regular tanto el ensamblaje como la actividad del complejo ciclina-Cdk. [22] La asociación de p27 con ciclina D-Cdk4/6 puede promover aún más la progresión del ciclo celular al limitar el grupo de p27 disponible para inactivar los complejos ciclina E-Cdk2. [8] [23] El aumento de la actividad de ciclina E-Cdk2 en G1 tardío (y ciclina A-Cdk2 en S temprano) conduce a la fosforilación de p21/p27 que promueve su exportación nuclear, ubiquitinación y degradación.
Un artículo publicado por los grupos de Lingchong You y Joe Nevins en la Universidad de Duke en 2008 demostró que un interruptor histérico biestable E2F subyace al punto de restricción. E2F promueve su propia activación y también promueve la inhibición de su propio inhibidor ( pRb ), formando dos bucles de retroalimentación (entre otros) que son importantes para establecer sistemas biestables. Los autores de este estudio utilizaron un sistema GFP desestabilizado bajo el control del promotor E2F como una lectura de la actividad E2F . Las células privadas de suero se estimularon con concentraciones séricas variables y la lectura de GFP se registró a nivel de una sola célula. Encontraron que el reportero GFP estaba encendido o apagado, lo que indica que E2F estaba completamente activado o desactivado en todos los diferentes niveles séricos analizados. Experimentos posteriores, en los que analizaron la dependencia histórica del sistema E2F, confirmaron que funciona como un interruptor biestable histérico . [24]
El cáncer puede verse como una alteración de la función normal del punto de restricción, ya que las células vuelven a ingresar al ciclo celular de manera continua e inapropiada y no ingresan a G 0 . [1] Las mutaciones en muchos pasos de la vía hacia el punto de restricción pueden provocar el crecimiento canceroso de las células. Algunos de los genes que mutan con mayor frecuencia en el cáncer incluyen Cdks y CKI; las Cdks hiperactivas o las CKI hipoactivas reducen la rigurosidad del punto de restricción, lo que permite que más células eviten la senescencia. [17]
El punto de restricción es un factor importante a tener en cuenta en el desarrollo de nuevas terapias farmacológicas. En condiciones fisiológicas normales, toda la proliferación celular está regulada por el punto de restricción. Esto se puede aprovechar y utilizar como una forma de proteger a las células no cancerosas de los tratamientos de quimioterapia . Los fármacos de quimioterapia suelen atacar a las células que proliferan rápidamente. Al utilizar fármacos que inhiben la finalización del punto de restricción, como los inhibidores del receptor del factor de crecimiento , se evita que las células normales proliferen y, por lo tanto, se las protege de los tratamientos de quimioterapia. [16]
{{cite book}}: CS1 maint: nombres múltiples: lista de autores ( enlace ) CS1 maint: nombres numéricos: lista de autores ( enlace )