( R )-prunasina es un glucósido cianogénico relacionado con la amígdala . Químicamente, es el glucósido del ( R ) -mandelonitrilo .
La prunasina se encuentra en especies del género Prunus como Prunus japonica o P. maximowiczii y en almendras amargas . [1] También se encuentra en hojas y tallos de Olinia ventosa , O. radiata , O. emarginata y O. rochetiana [2] y en Acacia greggii . Es un precursor biosintético e intermediario en la biosíntesis de la amígdala , el compuesto químico responsable del sabor de la almendra amarga . [ cita necesaria ]
También se encuentra en el café de diente de león , un sustituto del café. [ cita necesaria ]
Sambunigrina, un diastereómero de prunasina derivado del ( S )-mandelonitrilo en lugar del isómero ( R ), se ha aislado de las hojas del saúco ( Sambucus nigra ). [3] Sambunigrina está presente en las hojas y tallos de saúco en una proporción de 1:3 de sambunigrina a prunasina, y de 2:5 en la semilla inmadura. [4] No se encuentra en la raíz. [4]
( R )-prunasina comienza con el aminoácido común fenilalanina , que en las plantas se produce a través de la vía Shikimato en el metabolismo primario . La vía está catalizada principalmente por dos enzimas del citocromo P450 (CYP) y una UDP-glucosiltransferasa (UGT). Después de que se forma ( R ) -prunasina, se convierte en amigdalina mediante una UDP-glucosiltransferasa adicional o se degrada en benzaldehído y cianuro de hidrógeno.
Los investigadores han demostrado que la acumulación (o falta de) de prunasina y amigdalina en la almendra es responsable de los genotipos dulces y amargos. [1] Debido a que la amígdala es responsable del sabor amargo de las almendras, los productores de almendras han seleccionado genotipos que minimizan la biosíntesis de la amigdalina. Las enzimas CYP responsables de la generación de prunasina se conservan en todas las especies de Prunus . [5] Existe una correlación entre la alta concentración de prunasina en las regiones vegetativas de la planta y el dulzor de la almendra, lo cual es relevante para la industria agrícola de la almendra . En las almendras, los genes biosintéticos de la amígdala se expresan en diferentes niveles en el tegumento (tejido madre o sección externa) y el cotiledón (núcleo o tejido padre), y varían significativamente durante la ontogenia de la almendra . [1] [6] [7] La biosíntesis de prunasina ocurre en el tegumento y luego se transporta a otros tejidos para su conversión en amigdalina o su degradación. [ 15]
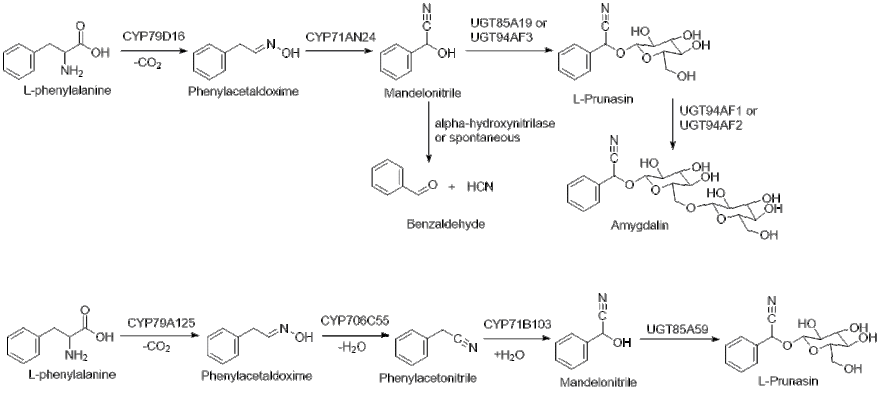
La L-fenilalanina es hidroxilada primero por CYP79D16, seguida de una descarboxilación y deshidratación, formando la E- oxima fenilacetaldoxima. [8] A continuación, CYP71AN24 cataliza la reordenación de la E- oxima a la Z- oxima seguida de una deshidratación y una hidroxilación para formar mandelonitrilo. [8] Finalmente, UGT85A19 o UGT94AF3 utilizan UDP-glucosa para glicosilar mandelonitrilo, formando ( R )-prunasina. [1]
Después de generar ( R ) -prunasina, el producto se glicosila aún más en amigdalina mediante la isoforma UGT94AF1 o UGT94AF2. [1] La expresión de UGTAF1/2 y prunasina hidrolasas da como resultado una concentración general baja de ( R )-prunasina en los tejidos de almendra. Es importante señalar que una alfaglucosidasa o prunasina hidrolasa puede convertir la ( R )-prunasina en mandelonitrilo, su precursor, que luego puede hidrolizarse espontánea o enzimáticamente a benzaldehído y cianuro de hidrógeno. [9]
Se ha demostrado que la biosíntesis de ( R )-prunasina en E. cladocalyx , el árbol de la goma de azúcar , sintetiza ( R )-prunasina utilizando un intermedio adicional, fenilacetonitrilo , utilizando CYP706C55. [10] La vía procede de manera similar a la vía en las especies de Prunus , donde el CYP79A125 multifuncional cataliza la conversión de L-fenilalanina en fenilacetaldoxima. Luego, CYP706C55 cataliza la deshidratación de fenilacetaldoxima a fenilacetonitrilo. Luego, el fenilacetonitrilo es hidroxilado por CYP71B103 a mandelonitrilo . Después de generar mandelonitrilo, UGT85A59 transfiere glucosa para producir ( R )-prunasina. [10]
Como ( R ) -prunasina es un producto del metabolismo secundario, su generación y degradación afectan múltiples vías metabólicas al consumir L-fenilalanina o cantidades crecientes de benzaldehído y cianuro de hidrógeno tóxico a través de la degradación de la prunasina.
El perfil metabólico en almendras, yuca y sorgo identificó un posible mecanismo de reciclaje en el que la ( R )-prunasina y otros glucósidos de cianógeno pueden utilizarse para el almacenamiento y el reciclaje de nitrógeno sin generar HCN. [11] En 2017, los investigadores utilizaron el marcaje con isótopos estables para demostrar que la L-fenilalanina marcada con 13 C incorporada en ( R )-prunasina podría convertirse en benzaldehído y ácido salicílico utilizando mandelonitrilo como intermediario. [12]
La toxicidad de la prunasina se basa en sus productos de degradación: ( R )-prunasina se hidroliza para formar benzaldehído y cianuro de hidrógeno , lo que provoca toxicidad. Por tanto, las plantas que contienen prunasina pueden ser tóxicas para los animales, especialmente los rumiantes . [13]
Para degradar la amigdalina a prunasina, la amigdalina beta-glucosidasa hidroliza el disacárido para producir ( R ) -prunasina y D -glucosa. Luego, la prunasina beta-glucosidasa utiliza ( R )-prunasina y agua para producir D - glucosa y mandelonitrilo . Después de generar la aglicona mandelonitrilo , una mandelonitrilo liasa puede degradar el compuesto en benzaldehído y cianuro de hidrógeno . [ cita necesaria ]